早教吧作业答案频道 -->化学-->
钼酸钠晶体(Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:(1)下列标志中,应贴在装有NaClO容
题目详情
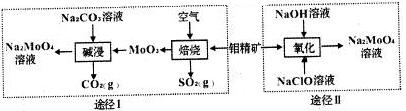
钼酸钠晶体(Na2MoO4•2H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
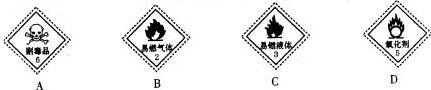
(1)下列标志中,应贴在装有NaClO容器上的是___.
NaClO的电子式是___.
(2)途径Ⅰ碱浸时发生反应的化学方程式为___.
(3)途径Ⅱ氧化时发生反应的离子方程式为___.
(4)钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的尾气一起通入水中,得到酸式盐的化学式是___.
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三中不同介质中的腐蚀速率实验结果如图:
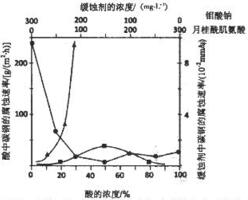
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为___.
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是___.
(6)常温下HClO的电离常数Ka=3.0×10-8,浓度均为0.5molL-1的NaClO和HClO的混合溶液中离子浓度由大到小的顺序为___.

(1)下列标志中,应贴在装有NaClO容器上的是___.

NaClO的电子式是___.
(2)途径Ⅰ碱浸时发生反应的化学方程式为___.
(3)途径Ⅱ氧化时发生反应的离子方程式为___.
(4)钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的尾气一起通入水中,得到酸式盐的化学式是___.
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三中不同介质中的腐蚀速率实验结果如图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为___.
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是___.
(6)常温下HClO的电离常数Ka=3.0×10-8,浓度均为0.5molL-1的NaClO和HClO的混合溶液中离子浓度由大到小的顺序为___.
▼优质解答
答案和解析
利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;据此分析
(1)NaClO是一种强氧化剂,所以贴在装有NaClO容器上的是D,NaClO是离子化合物NaClO的电子式为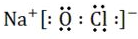 ,
,
故答案为:D;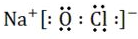 ;
;
(2)途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)CO2和NH3一起通入水中生成的酸式盐为碳酸氢铵,化学式为NH4HCO3,如果是SO2气体则生成酸式盐为NH4HSO3,
故答案为:NH4HSO3;NH4HCO3;
(5)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,
故答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(6)常温下HClO的电离常数Ka=3.0×10-8,即HClO为极弱的酸,所以NaClO水解溶液呈碱性,所以在等浓度的NaClO和HClO的混合溶液中离子浓度由大到小的顺序为c(Na+)>c(ClO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)NaClO是一种强氧化剂,所以贴在装有NaClO容器上的是D,NaClO是离子化合物NaClO的电子式为
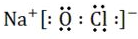 ,
,故答案为:D;
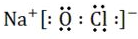 ;
;(2)途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
(3)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,
故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)CO2和NH3一起通入水中生成的酸式盐为碳酸氢铵,化学式为NH4HCO3,如果是SO2气体则生成酸式盐为NH4HSO3,
故答案为:NH4HSO3;NH4HCO3;
(5)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,
故答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,
故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(6)常温下HClO的电离常数Ka=3.0×10-8,即HClO为极弱的酸,所以NaClO水解溶液呈碱性,所以在等浓度的NaClO和HClO的混合溶液中离子浓度由大到小的顺序为c(Na+)>c(ClO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(ClO-)>c(OH-)>c(H+).
看了钼酸钠晶体(Na2MoO4•2...的网友还看了以下:
已知关于X的一元二次方程x^2+2(k-1)x+k^2-1=0有两个不相等的实数根已知关于x的一元 2020-05-16 …
已知关于x的一元一次方程x^2+mx+2m-1=0的两个实数根的平方和为23,求m的值.某同学的解 2020-05-23 …
观察下列两组算式(2*3)^2与2^2*3^2[(-1/3)*6]^2与(-1/3)^观察下列两组 2020-07-22 …
(x-2)^2=9(x+3)(步骤)用十字相乘法:x^2-5倍的根号2*x+83x^2-2x-1= 2020-08-03 …
在1、2两个数之间,第一次写上1+2/1=3;第2次在1和3之间,3和2之间分别写上1+3/2=2, 2020-11-24 …
计算(3*5)^2与3^2*5^2与[(-1/2)*4]^2与(-1/2)^2*4^2两个算式的计算 2020-12-09 …
下面是一道选择题的两种解法,两种解法看似都对,可结果并不一致,问题出在哪儿?[题]在△ABC中,a= 2020-12-13 …
某社区倡导人人都是志愿者,人人参与公益活动,用每个人的热情去激活社会正能量,实现“微志愿—微文明—大 2020-12-27 …
在两枚1分,两枚2分,和三枚5分的硬币中,随意取出两枚,则取出的币值恰好是七分的概率是?我算的是2/ 2020-12-31 …
做两个水池安装两个2一4千吨浮球两池水自动互换.两个浮球一上一下行...做两个水池安装两个2一4千吨 2021-01-07 …