早教吧作业答案频道 -->化学-->
二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂.(1)KC103和浓盐酸在一定温度下反应会生成Cl02,反应方程为2KCl03十4HCl(浓)═2KCl+2Cl02↑+Cl2↑+2H20,浓盐酸在该反应中表现出的性质
题目详情
二氧化氯(ClO2)气体是一种常用高效的自来水消毒剂.
(1)KC103和浓盐酸在一定温度下反应会生成Cl02,反应方程为2KCl03十4HCl(浓)═2KCl+2Cl02↑+Cl2↑+2H20,浓盐酸在该反应中表现出的性质是___.
(2)实验室常用KCl03.草酸(H2C204)和稀硫酸制备C102.该反应中氧化产物与还原产物物质的量之比为___
(3)将Cl02通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成.写出二氧化氯与硫化氢溶液反应的离子方程式___
(4)C102和Cl2在消毒时自身均被还原为Cl一,则常温常压下,等体积的C102的消毒能力是Cl2的___倍.
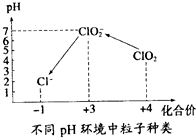
(5)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1-0.8mg.L-1之间.碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S203溶液.(己知:2S2O
+I2═SO+2I-)
Ⅲ.加硫酸调节水样pH至1--3.
请问答:
①操作I中反应的离子方程式是___
②在操作III过程中,溶液又呈蓝色,反应的离子方程式是___
③若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol•L一1,的Na2S203溶液10mL.则水样中Cl02的浓度是___ mg•L一1.

(1)KC103和浓盐酸在一定温度下反应会生成Cl02,反应方程为2KCl03十4HCl(浓)═2KCl+2Cl02↑+Cl2↑+2H20,浓盐酸在该反应中表现出的性质是___.
(2)实验室常用KCl03.草酸(H2C204)和稀硫酸制备C102.该反应中氧化产物与还原产物物质的量之比为___
(3)将Cl02通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成.写出二氧化氯与硫化氢溶液反应的离子方程式___
(4)C102和Cl2在消毒时自身均被还原为Cl一,则常温常压下,等体积的C102的消毒能力是Cl2的___倍.
(5)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1-0.8mg.L-1之间.碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ.加入一定量的Na2S203溶液.(己知:2S2O
| 2- 3 |
Ⅲ.加硫酸调节水样pH至1--3.
请问答:
①操作I中反应的离子方程式是___
②在操作III过程中,溶液又呈蓝色,反应的离子方程式是___
③若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol•L一1,的Na2S203溶液10mL.则水样中Cl02的浓度是___ mg•L一1.
▼优质解答
答案和解析
(1)根据KC1O3和浓盐酸反应的方程式可知,浓盐酸中部分氯元素的化合价从-1升为0价,还有部分生成氯化钾,所以浓盐酸在该反应中表现出的性质是还原性和酸性,
故答案为:还原性和酸性;
(2)KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,反应的方程式为2KClO3+H2C2O4+2H2SO4
2ClO2↑+2CO2↑+2KHSO4+2H2O,氧化产物为CO2,还原产物为ClO2,二者物质的量之比为1:1;
故答案为:1:1;
(3)硫酸钡难溶于盐酸,即反应生成硫酸钡,ClO2通入到硫化氢溶液中,生成了硫酸根,所以离子反应方程式为:5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-,
故答案为:5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-;
(4)molC1O2和Cl2在消毒时自身均被还原为Cl-,每molC1O2被还原为Cl-,要得5mol电子,每molC12被还原为Cl-,要得2mol电子,根据电子转移数目相等可知等体积的C1O2的消毒能是Cl2的2.5倍,
故答案为:2.5;
(5)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,
故答案为:2ClO2+2I-=2ClO2-+I2;
②由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
③S2O32-~~~~I-~~~~ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为
=0.675 mg•L-1,
故答案为:0.675.
故答案为:还原性和酸性;
(2)KClO3和草酸(H2C2O4)在酸性条件下反应生成ClO2、CO2和KHSO4,反应的方程式为2KClO3+H2C2O4+2H2SO4
| ||
故答案为:1:1;
(3)硫酸钡难溶于盐酸,即反应生成硫酸钡,ClO2通入到硫化氢溶液中,生成了硫酸根,所以离子反应方程式为:5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-,
故答案为:5H2S+8ClO2+4H2O=18H++5SO42-+8Cl-;
(4)molC1O2和Cl2在消毒时自身均被还原为Cl-,每molC1O2被还原为Cl-,要得5mol电子,每molC12被还原为Cl-,要得2mol电子,根据电子转移数目相等可知等体积的C1O2的消毒能是Cl2的2.5倍,
故答案为:2.5;
(5)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,
故答案为:2ClO2+2I-=2ClO2-+I2;
②由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
③S2O32-~~~~I-~~~~ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为
| 0.675mg |
| 1L |
故答案为:0.675.
看了二氧化氯(ClO2)气体是一种...的网友还看了以下:
人类免疫缺陷病毒(HIV)属于逆转录病毒,图为HIV复制过程示意图.请据图回答下列问题:(l)HI 2020-05-13 …
有氧呼吸过程中释放的CO2中的氧()A.全部来自氧气B.全部来自水C.全部来自葡萄糖D.来自葡萄糖 2020-05-14 …
Na在常温下与氧气:4Na+O2=2Na2ONa与氧气燃烧:2Na+O2=Na2O2各自方程中转移 2020-05-14 …
硝化作用指的是在氧存在下,废水中氨氮被自氧化菌氧化为硝化作用指的是在氧存在下,废水中氨氮被自氧化菌 2020-05-17 …
为实现程序指令的顺序执行,CPU(1)中的值将自动加l。A.指令寄存器(IR)B.程序计数器(PC) 2020-05-26 …
有氧呼吸产物二氧化碳中的氧和水中的氧A.都来自葡萄糖B.都来自氧气和水C.分别来自葡萄糖和水,氧气 2020-06-30 …
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnS 2020-07-01 …
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnS 2020-07-01 …
一种计算装置,有一个数据输入口A和一个运算输出口B,执行的运算程序是:①当从A口输入自然数l时,从B 2020-11-30 …
在初速为u的匀加速运动中,路程L和时间x的关系为L=L(x)=ux+(ax^2/2).(1)求L关于 2020-12-09 …