早教吧作业答案频道 -->化学-->
CO是主要的大气污染气之一,但也是中药的工业原料.(1)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g)⇌CO2(g)+N2(g)△H,有关化学反应的物质变化
题目详情
CO是主要的大气污染气之一,但也是中药的工业原料.
(1)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g)⇌CO2(g)+N2(g)△H,有关化学反应的物质变化过程(图1)及能量变化过程如(图2):
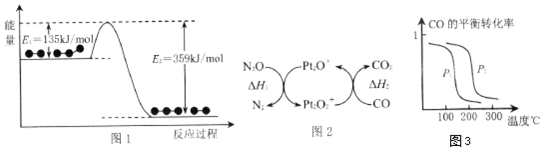
①由图1可知:△H=___;该反应正反应的活化能___逆反应的活化能(选填“大于”、“小于”或“等于”);
②由图2可知,△H、△H1、△H2三者的关系为___.
(2)CO在催化剂作用下可用于合成甲醇:CO(g)+2H2 (g)⇌CH3OH (g)△H=-91kJ/mol,
在密闭容器中充入1molCO和2molH2,平衡时,CO的转化率与温度、压强的关系如图3.
①P1___P2(填“>”、“<”或“=”),理由是___;
②在温度、容积不变的情况下,向该密闭容器中再增加a molCO与2a molH2,达到新平衡时,CH3OH的百分含量___(填“增大”、“减小”或“不变”),平衡常数___(填“增大”、“减小”或“不变”).
(3)一定条件下,甲醇与CO反应可以合成乙酸:常温下,将c1 mol/L的CH3COOH溶液与c2 mol/L的NaOH溶液等体积混合(忽略混合过程中溶液的体积变化),反应平衡时,c(Na+)=c(CH3COO-),用含c1和c2的代数式表示该混合液中醋酸的电离平衡常数为___.
(1)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g)⇌CO2(g)+N2(g)△H,有关化学反应的物质变化过程(图1)及能量变化过程如(图2):

①由图1可知:△H=___;该反应正反应的活化能___逆反应的活化能(选填“大于”、“小于”或“等于”);
②由图2可知,△H、△H1、△H2三者的关系为___.
(2)CO在催化剂作用下可用于合成甲醇:CO(g)+2H2 (g)⇌CH3OH (g)△H=-91kJ/mol,
在密闭容器中充入1molCO和2molH2,平衡时,CO的转化率与温度、压强的关系如图3.
①P1___P2(填“>”、“<”或“=”),理由是___;
②在温度、容积不变的情况下,向该密闭容器中再增加a molCO与2a molH2,达到新平衡时,CH3OH的百分含量___(填“增大”、“减小”或“不变”),平衡常数___(填“增大”、“减小”或“不变”).
(3)一定条件下,甲醇与CO反应可以合成乙酸:常温下,将c1 mol/L的CH3COOH溶液与c2 mol/L的NaOH溶液等体积混合(忽略混合过程中溶液的体积变化),反应平衡时,c(Na+)=c(CH3COO-),用含c1和c2的代数式表示该混合液中醋酸的电离平衡常数为___.
▼优质解答
答案和解析
(1)①图2分析可知,反应物能量高于生成物,反应为放热反应,反应焓变△H=生成物总焓-反应物总焓=135KJ/mol-359KJ/mol=-226KJ/mol,该反应正反应的活化能小于逆反应的活化能,故答案为:-224KJ/mol;小于;
②、①N2O+Pt2O+=Pt2O2++N2△H1,②Pt2O2++CO=Pt2O++CO2△H2,
结合盖斯定律计算①+②得到N2O(g)+CO(g)=CO2(g)+N2(g)△H=△H1+△H2,故答案为:△H=△H1+△H2;
(2)①甲醇的合成反应是气体体积减小的反应,相同温度下,增大压强平衡正向移动,CO的平衡转化率增大,故答案为:<;甲醇的合成反应是气体体积减小的反应,相同温度下,增大压强平衡正向移动,CO的平衡转化率增大;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.
平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变;
(3)常温下,将c1mol/L的CH3COOH溶液与c2mol/L的NaOH溶液等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+)=0.5c2mol/L,根据电荷守恒可得c(OH-)=c(H+),常温下的中性溶液中c(OH-)=c(H+)=10-7mol/L,c(CH3COOH)=0.5(c1mo/L-c2mol/L),醋酸的电离平衡常数为:K=
=
,故答案为
.
②、①N2O+Pt2O+=Pt2O2++N2△H1,②Pt2O2++CO=Pt2O++CO2△H2,
结合盖斯定律计算①+②得到N2O(g)+CO(g)=CO2(g)+N2(g)△H=△H1+△H2,故答案为:△H=△H1+△H2;
(2)①甲醇的合成反应是气体体积减小的反应,相同温度下,增大压强平衡正向移动,CO的平衡转化率增大,故答案为:<;甲醇的合成反应是气体体积减小的反应,相同温度下,增大压强平衡正向移动,CO的平衡转化率增大;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.
平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变;
(3)常温下,将c1mol/L的CH3COOH溶液与c2mol/L的NaOH溶液等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+)=0.5c2mol/L,根据电荷守恒可得c(OH-)=c(H+),常温下的中性溶液中c(OH-)=c(H+)=10-7mol/L,c(CH3COOH)=0.5(c1mo/L-c2mol/L),醋酸的电离平衡常数为:K=
| c(H+)•c(CH3COO-) |
| c(CH3COOH) |
| 10-7c2 |
| c1-c2 |
| 10-7c2 |
| c1-c2 |
看了CO是主要的大气污染气之一,但...的网友还看了以下:
乙烯能否与过氧化氢发生加成反应?H-O-O-H+CH2=CH2==H-O-CH2-CH2-O-H 2020-05-16 …
H-O-H,每mol水中含2molH-O键含2mol的H-O键,H-O-H中的H-O?H-O是什么 2020-06-28 …
已知N2+3H22NH3△H<O,反应速率为V1;2HIH2+I2△H>O,反应速率为V2。对于上 2020-07-12 …
(4分)氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436kJ/mo 2020-07-19 …
科学家对H2O2的推测:(1)两个H连接在O→O上(2)H-O-O-H.(式子中O→O表示配位键) 2020-07-28 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
二氧化碳能溶于水是物理性质可是和水反应明明就是化学反应啊rt说二氧化碳溶于水是化学反应CO?+H?O 2020-11-03 …
下列有关物质性质的比较顺序中,不正确的是()A.热稳定性:NH3>PH3>SiH4B.微粒半径:K+ 2020-11-26 …
下列有关物质性质的比较顺序中,不正确的是()A.热稳定性:NH3>PH3>SiH4B.微粒半径:K+ 2020-12-12 …
下列各项中,理由、结论及因果关系均正确的是()选项理由结论A共价键强弱:O-H>S-H沸点:H2O> 2020-12-23 …