早教吧作业答案频道 -->化学-->
电镀废水中常含有NaCN,工业上规定其含量低于0.5mg/L才可排放,对NaCN超标的废水可用两段氧化法处理:己知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同.请回答下列
题目详情
电镀废水中常含有NaCN,工业上规定其含量低于0.5mg/L才可排放,对NaCN超标的废水可用两段氧化法处理:
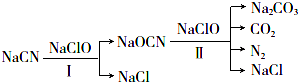
己知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同.
请回答下列问题:
(1)第一次氧化时,溶液的pH应调节为___(填“酸性”、“碱性”或“中性”);原因是___.反应中,欲使1mol NaCN变为NaOCN,则需要氧化剂NaClO至少为___mol.
(2)写出第二次氧化时发生反应的离子方程式:___.反应中被氧化的元素是___.
(3)处理10m3含NaCN 10.3mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使废水中NaCN含量达到排放标准.
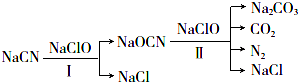
己知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同.
请回答下列问题:
(1)第一次氧化时,溶液的pH应调节为___(填“酸性”、“碱性”或“中性”);原因是___.反应中,欲使1mol NaCN变为NaOCN,则需要氧化剂NaClO至少为___mol.
(2)写出第二次氧化时发生反应的离子方程式:___.反应中被氧化的元素是___.
(3)处理10m3含NaCN 10.3mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使废水中NaCN含量达到排放标准.
▼优质解答
答案和解析
(1)NaCN易与酸反应生成HCN,为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性;NaCN与NaClO反应生成NaOCN和NaCl,其反应方程式为:NaCN+NaClO=NaOCN+NaCl,所以欲使1molNaCN变为NaOCN,则需要氧化剂NaClO为1mol;
故答案为:碱性;防止生成HCN,造成人员中毒或污染空气;1;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑,氮元素被氧化.
故答案为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;氮;
(3)参加反应的NaCN是:
=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:
×74.5g/mol×4=1490g,
故答案为:1490.
故答案为:碱性;防止生成HCN,造成人员中毒或污染空气;1;
(2)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑,氮元素被氧化.
故答案为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;氮;
(3)参加反应的NaCN是:
| 100(10.3-0.5)g |
| 49g/mol |
| 20mol×5 |
| 2 |
故答案为:1490.
看了电镀废水中常含有NaCN,工业...的网友还看了以下:
有关于化学计算的1.某+2价的金属氧化物的相对分子量是80,则她的相同价态的氧化物的相对分子质量是 2020-05-13 …
化合价的问题帮我区分以下化合价口诀哪个更好一价氢锂钾钠银二价钙镁铜钡锌三价铝和铁四价碳五价磷铜一铁 2020-05-20 …
请高手写个公式,前21-25天的最高价是240天内的最高价,前3-6天的最低价是30天内的最低价, 2020-07-09 …
碳有几种负化合价?碳的化合价有很多,那么它有几种负的化合价呢?请知道的速回答.谢谢! 2020-07-17 …
有关碳原子的问题碳原子含有个价电子,每个碳原子可以和其它元素的原子形成个键.碳原子间也能以键结合, 2020-07-22 …
下列共价键①H-H、②H-F、③H-O、④N-H、⑤P-H中,键的极性由小到大的顺序正确的是()A 2020-07-29 …
在挺中C=C的健长在什么情况下比一般的C=C的健长短分子式为C5H4中,有三中不同的氢、四种不同的碳 2020-10-31 …
分子式为C3H6O2的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式,每小题只写 2020-11-07 …
某小组同学用高度h不同的三个实心圆柱体进行实验,研究将它们水平切去相同厚度△h后,剩余部分对水平地面 2020-12-19 …
为什么PH值相同,等体积的一元弱酸的c(酸)大于一元强酸的?用公式解释下PH相同,即c(H+)相同而 2020-12-31 …