早教吧作业答案频道 -->化学-->
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)⇔C8H8(g)+H2(g)△H=125kJ•mol-1I.某温度下,将0.40mol苯乙烷,充人2L真空密闭容器中发生反应,测定不同时间该容器
题目详情
苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g)⇔C8H8(g)+H2(g)△H=125kJ•mol-1
I.某温度下,将0.40mol苯乙烷,充人2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
(1)当反应进行到20min时,该段时间内H2的平均反应速率是___.
(2)该温度下,该反应的化学平衡常数是___.
(3)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是___.此时,该反应是否达到了平衡状态?___(填“是”或“否”)
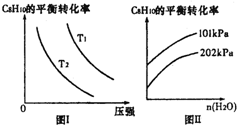
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图I、图Ⅱ所示.
(4)由图I可知,T1___T2 (填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,平衡转化率将___(填“越大”、“越小”或“不变”),原因是___.
C8H10(g)⇔C8H8(g)+H2(g)△H=125kJ•mol-1
I.某温度下,将0.40mol苯乙烷,充人2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)该温度下,该反应的化学平衡常数是___.
(3)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是___.此时,该反应是否达到了平衡状态?___(填“是”或“否”)
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图I、图Ⅱ所示.
(4)由图I可知,T1___T2 (填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,平衡转化率将___(填“越大”、“越小”或“不变”),原因是___.

▼优质解答
答案和解析
I.(1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.26mol,减少了0.14mol,
C8H10(g)⇌C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
v(H2)=
=0.0035mol/(L•min)
故答案为:0.0035mol/(L•min);
(2)C8H10(g)⇌C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.08 0.08 0.08
30min(mol/L) 0.12 0.08 0.08
化学平衡常数K=
=
=0.053;
故答案为:0.053;
(3)根据C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)⇌C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率=
×100%=
×100%=60%;
根据(2)知:平衡常数=0.053,则C8H8(g)+H2(g)⇌C8H10(g)的平衡常数为
=18.75,
C8H8(g)+H2(g)⇌C8H10(g)
起始(mol/L) 0.2 0.2 0
变化(mol/L) 0.12 0.12 0.12
某时刻(mol/L) 0.08 0.08 0.12
=
=18.75=18.75,反应达到平衡状态;
故答案为:60%;是;
Ⅱ.(4)C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;
故答案为:大于;
(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;
故答案为:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
C8H10(g)⇌C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.14 0.14 0.14
20min(mol) 0.26 0.14 0.14
v(H2)=
| ||
| 20min |
故答案为:0.0035mol/(L•min);
(2)C8H10(g)⇌C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.08 0.08 0.08
30min(mol/L) 0.12 0.08 0.08
化学平衡常数K=
| c(C8H8)•c(H2) |
| c(C8H10) |
| 0.08×0.08 |
| 0.12 |
故答案为:0.053;
(3)根据C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,可知 C8H8(g)+H2(g)⇌C8H10(g)△H=-125kJ•mol-1,有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率=
| 消耗量 |
| 起始量 |
| 0.24mol |
| 0.4mol |
根据(2)知:平衡常数=0.053,则C8H8(g)+H2(g)⇌C8H10(g)的平衡常数为
| 1 |
| 0.053 |
C8H8(g)+H2(g)⇌C8H10(g)
起始(mol/L) 0.2 0.2 0
变化(mol/L) 0.12 0.12 0.12
某时刻(mol/L) 0.08 0.08 0.12
| c(C8H10) |
| c(C8H8)c(H2) |
| 0.12 |
| 0.08×0.08 |
故答案为:60%;是;
Ⅱ.(4)C8H10(g)⇌C8H8(g)+H2(g)△H=125kJ•mol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;
故答案为:大于;
(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;
故答案为:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
看了苯乙烷(C8H10)可生产塑料...的网友还看了以下:
(6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。(1)在不同温度下,反应 2020-05-14 …
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)在不同温度下,反应N2(g 2020-05-14 …
加热同一物体,在不同温度背景下,升高相同温度所用时间是否相同?即相同质量比热不变的物体,升高相同温 2020-06-07 …
已知(HF)2(g)2HF(g)ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同 2020-07-05 …
硫酸工业用SO2制取SO3的反应为2SO2(g)+O2(g)催化剂△2SO3(g)△H=-47kJ 2020-07-09 …
反应Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1平衡常数为K1Fe(s)+H2O(g) 2020-07-18 …
(二二14•怀化三模)已知;①Fe(s)+Cu二(g)⇌Feu(s)+Cu(g)△H=得kJ•mul 2020-11-12 …
氮的固定是几百年来科学家一直研究的课题.(1)下表列举了不同温度下大气固氮的部分K值.反应大气固氮N 2020-11-28 …
大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和 2020-12-31 …
已知反应:Fe(s)+CO2(g)═FeO(s)+CO(g)△H=akJ•mol-1,测得在不同温度 2021-01-22 …