海水是个巨大的宝库,下列关于海水综合利用的说法不正确的是()A.步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaO溶液→BaCl2溶液→Na2CO3溶液→
海水是个巨大的宝库,下列关于海水综合利用的说法不正确的是( )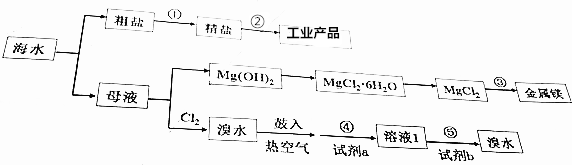
A. 步骤①中,除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaO溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
B. 步骤②的工业产品包括:H2、Cl2、NaOH、Na
C. 步骤③的方法为点解饱和MgCl2溶液
D. 步骤④、⑤中,若试剂a为SO2水溶液,则试剂b可以是Cl2
母液中主要是溴离子和镁离子,通入氯气氧化溴离子为溴单质,吹出后和二氧化硫气体通入水中得到卤水溶液和溴化氢溶液,富集溴,适量氯气氧化溴化氢为溴单质;含氯化镁的溶液,沉淀镁离子,过滤后在沉淀中加入盐酸溶解,通过浓缩蒸发,冷却结晶过滤洗涤得到氯化镁晶体,失水得到氯化镁固体,电解得到镁,
A、Ca2+用碳酸钠转化为沉淀、Mg2+用NaOH转化为沉淀、SO42-用氯化钡溶液转化为沉淀,先除去Mg2+或SO42-,然后再加入过量的碳酸钠除去Ca2+以及过量的Ba2+杂质,过滤后再加盐酸除去过量的NaOH和碳酸钠,故A正确;
B、步骤②为电解氯化钠制备工业产品,电解熔融状态下的氯化钠制备金属钠和氯气,电解饱和食盐水制备氢氧化钠、氯气和氢气,故B正确;
C、制备镁的方法为电解熔融的氯化镁,故C错误;
D、步骤⑤⑤已经获得Br2浓度较低,应进行富集,与二氧化硫反应后得到浓度角度的溴化氢溶液,然后通入氯气可得到纯溴,故D正确;
故选C.
下列词语中加点的字,读音全都正确的一组是()A.折(zhé)耗绰(chuò)约水泵(bènɡ)流水 2020-05-14 …
求证:(1)A(n+1,n+1)-A(n,n)=n^2A(n-1,n-1);(2)C(m,n+1) 2020-06-03 …
A.阔绰(chuò)羼水(càn)活泼(pō)B.荤素(yūn)暂时(zàn)蒲包(pú)C.荐头 2020-06-28 …
下列词语中加点的字,读音全都正确的一组是()(3分)A.剜肉(wān)岑寂(céng)蟊贼(máo 2020-07-02 …
已知数列{an}的通项公式为an=2^(n-1)+1则a1Cn^0+a2Cn^1+a3Cn^2+. 2020-07-09 …
下列加点字的注音全部正确的一项是()A.深邃suì终年不涸hé峰峦1uán黄澄澄dēngB.霓虹n 2020-07-24 …
什么是二项式的通式?在二项式定理(a+b)^n=C(n,0)a^n+C(n,1)a^(n-1)b+ 2020-07-31 …
下列各项中注音有误的一项是()A、伺候cì装殓zhuāngliǎn装帧zhuāngzhēnB、卓见z 2020-11-06 …
选出下面各项中字音有误的一项:A攒钱zǎn篡改cuàn编纂zuǎn璀璨cànB皴裂cūn忖度cǔn淙 2020-11-07 …
静止在水平地面上的物体受到重力G和支持力N的作用,物体对地面的压力为F,则以下说法中正确的是()A. 2020-12-17 …