早教吧作业答案频道 -->化学-->
以磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)为原料可制备轻质CaCO3.(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见图.清液pH>11时CaSO4转化的离子方程式.(2)当清
题目详情
以磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)为原料可制备轻质CaCO3.
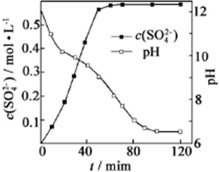
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见图.清液pH>11时CaSO4转化的离子方程式___.
(2)当清液pH接近6.5时,过滤并洗涤固体.滤液中物质的量浓度最大的两种阴离子为SO42-和___(填化学式);检验洗涤是否完全的方法是___.
(3)磷石膏若用氢氧化钠溶液溶解,发生反应的有关离子方程式为:___.

(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见图.清液pH>11时CaSO4转化的离子方程式___.

(2)当清液pH接近6.5时,过滤并洗涤固体.滤液中物质的量浓度最大的两种阴离子为SO42-和___(填化学式);检验洗涤是否完全的方法是___.
(3)磷石膏若用氢氧化钠溶液溶解,发生反应的有关离子方程式为:___.
▼优质解答
答案和解析
磷石膏氨水的浆料中通入二氧化碳可生成碳酸盐或碳酸氢盐,过滤后滤液为硫酸铵、氨水,滤渣含有碳酸钙、SiO2、Al2O3等,高温煅烧生成硅酸钙、偏铝酸钙等,加入氯化铵溶液充分浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成碳酸钙.
(1)由图象可知,经充分浸取,c(SO42-)逐渐增大,pH逐渐减小,清液pH>11时CaSO4生成碳酸钙、铵根离子和硫酸根离子,反应的离子方程式为CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42-+H2O或CaSO4+CO32-=CaCO3+SO42-,
故答案为:CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42-+H2O或CaSO4+CO32-=CaCO3+SO42-;
(2)当清液pH接近6.5时,溶液酸性相对较强,可充分转化生成SO42-并有HCO3-生成,沉淀吸附SO42-,可用盐酸酸化的氯化钡检验,方法是取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全,
故答案为:HCO3-;取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全;
(3)磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)用氢氧化钠溶液溶解,氧化铝为两性氧化物,能和氢氧化钠反应生成偏铝酸钠和水,离子反应为:Al2O3+2OH-+3H2O═2[Al(OH)4]-,二氧化硅为酸性氧化物和氢氧化钠反应生成硅酸钠和水,离子反应为:SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-;SiO2+2OH-═SiO32-+H2O.
(1)由图象可知,经充分浸取,c(SO42-)逐渐增大,pH逐渐减小,清液pH>11时CaSO4生成碳酸钙、铵根离子和硫酸根离子,反应的离子方程式为CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42-+H2O或CaSO4+CO32-=CaCO3+SO42-,
故答案为:CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42-+H2O或CaSO4+CO32-=CaCO3+SO42-;
(2)当清液pH接近6.5时,溶液酸性相对较强,可充分转化生成SO42-并有HCO3-生成,沉淀吸附SO42-,可用盐酸酸化的氯化钡检验,方法是取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全,
故答案为:HCO3-;取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全;
(3)磷石膏(主要成分CaSO4,杂质SiO2、A12O3等)用氢氧化钠溶液溶解,氧化铝为两性氧化物,能和氢氧化钠反应生成偏铝酸钠和水,离子反应为:Al2O3+2OH-+3H2O═2[Al(OH)4]-,二氧化硅为酸性氧化物和氢氧化钠反应生成硅酸钠和水,离子反应为:SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-;SiO2+2OH-═SiO32-+H2O.
看了以磷石膏(主要成分CaSO4,...的网友还看了以下:
质量为M=2kg,长为l=5m的薄木板,在水平向右的力F=10N作用下,以v0=6m/s的速度匀速 2020-05-17 …
质量分别为m和2m的两个小物体可视为质点,用轻质细线连接,跨过光滑圆柱体,轻的着地,重的恰好与圆心 2020-05-23 …
一质量为M=2kg、长为L=3.75m的薄木板,在水平向右F=l0N的拉力作用下,以v0=5m/s 2020-06-12 …
一质量为M=4.0kg、长度为L=3.0m的木板B,在大小为8N、方向水平向右的拉力F作用下,以v 2020-06-22 …
,绷紧的传送带与水平面的夹角θ=30°,皮带在电动机的带动下,始终保持v0=2m/s的速率运行.现 2020-06-29 …
如图所示,质量分别为m1和m2的两个球,用不计质量的轻质弹簧连在一起,且以长为l1的线拴在轴上,m 2020-07-11 …
濡錩炬绀猴糭浼犻甯︿竉鎋瀹鏮开搴如图所示,水平传送带以恒定的速度2m/s向左运动,将物体(可视为质 2020-07-23 …
一质量为M=4Kg、长度为L=3m的木板,在F=8N、水平向右的拉力作用下,以v0=2.0m/s的速 2020-11-01 …
如图所示,水平地面上一个质量M=4.0kg、长度L=2.0m的木板,在F=8.0N的水平拉力作用下, 2020-11-21 …
如图所示,甲、乙两传送带与水平面的夹角相同,都以恒定速率v向上运动.现将一质量为m的小物体(视为质点 2020-12-03 …