早教吧作业答案频道 -->化学-->
环己酮是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.+Na2Cr2O7+H2SO455℃~60℃+H2O实验室可用环己醇氧化制取环己酮(已知该反应为放热反
题目详情
环己酮是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.
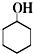 +Na2Cr2O7+H2SO4
+Na2Cr2O7+H2SO4
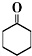 +H2O
+H2O
实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
实验步骤如下:
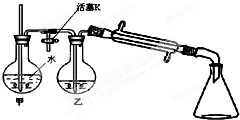
①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是___.
(2)步骤③利用图示装置进行实验的目的是___,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是___,此时应立即采取的措施是___.
(3)步骤④中操作的正确顺序是___,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需___,在上述操作d中加入NaCl 固体的作用是___,e中加入无水MgSO4的作用是___,蒸馏除乙醚的过程中采用的加热方式为___.
(4)写出该实验中可能发生的一个副反应的化学方程式___.
 +Na2Cr2O7+H2SO4
+Na2Cr2O7+H2SO4 | 55℃~60℃ |
| |
 +H2O
+H2O实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水和醚 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 0.9982 |
实验步骤如下:

①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是___.
(2)步骤③利用图示装置进行实验的目的是___,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是___,此时应立即采取的措施是___.
(3)步骤④中操作的正确顺序是___,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需___,在上述操作d中加入NaCl 固体的作用是___,e中加入无水MgSO4的作用是___,蒸馏除乙醚的过程中采用的加热方式为___.
(4)写出该实验中可能发生的一个副反应的化学方程式___.
▼优质解答
答案和解析
(1)环己醇氧化为环己酮为放热反应,温度过高会引起副反应,故答案为:环己醇氧化为环己酮为放热反应,防止温度过高副反应增多;
(2)蒸馏出产品环已酮;玻管内的水位升高过多,说明压强过大,系统有堵塞现象,应让水蒸汽发生器和大气相通,故答案为:蒸馏出产品环已酮;系统有堵塞现象;打开止水夹K(让水蒸汽发生器和大气相通);
(3)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,水与有机物更容易分离开,然后向有机层中加入无水MgSO4,除去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,则操作为d b e c a;
分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器;联系制取肥皂的盐析原理,即增加水层的密度,有利于分层,环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来;乙醚沸点34.6℃,可用水浴加热,
故答案为:d b e c a;漏斗、分液漏斗;增加水层的密度,有利于分层;干燥剂;水浴加热;
(4)羟基能发生消去反应,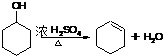 ,故答案为:
,故答案为: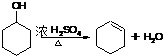 .
.
(2)蒸馏出产品环已酮;玻管内的水位升高过多,说明压强过大,系统有堵塞现象,应让水蒸汽发生器和大气相通,故答案为:蒸馏出产品环已酮;系统有堵塞现象;打开止水夹K(让水蒸汽发生器和大气相通);
(3)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,水与有机物更容易分离开,然后向有机层中加入无水MgSO4,除去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,则操作为d b e c a;
分液需要的主要仪器为分液漏斗,过滤需要由漏斗组成的过滤器;联系制取肥皂的盐析原理,即增加水层的密度,有利于分层,环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来;乙醚沸点34.6℃,可用水浴加热,
故答案为:d b e c a;漏斗、分液漏斗;增加水层的密度,有利于分层;干燥剂;水浴加热;
(4)羟基能发生消去反应,
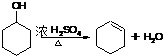 ,故答案为:
,故答案为: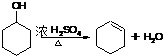 .
.
看了环己酮是一种重要的有机化工原料...的网友还看了以下:
在实验室制盐酸的反应中,为什么要提供强热才是硫酸钠,请问,在实验室制盐酸的反应中,为什么要提供强热 2020-04-06 …
硫酸和盐酸既是实验室硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料.它们既有相似之处,又有不同 2020-05-13 …
盐酸和醋酸分别加入适量锌粉,为什么醋酸PH变化比盐酸快?O(∩_∩)O谢谢 2020-05-16 …
下列反应不属于离子反应的是A实验室用氯酸钾制取氧气.B实验室用大理石和稀盐酸制取二氧化碳.C实验室 2020-05-21 …
酸和醇是与稀硫酸共热还是和浓硫酸才生成酯?rt,书上说实验室制乙酸乙酯是乙醇和乙酸与浓硫酸共热生成 2020-05-22 …
化验室用水稀释硫酸:将硫酸沿敞口容器壁缓慢加入水中,并不断搅拌哪里不对?化验室用水稀释硫酸的正确方 2020-06-27 …
室温时向一瓶饱和碳酸钠溶液中加入少量碳酸钠晶体,晶体的质量,溶液溶质的质量分数室温时向一瓶饱和碳酸 2020-07-05 …
高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如图: 2021-01-07 …
(2009•开封一模)下列叙述不正确的是()A.SiO2和CO2中Si和O,C和O之间都是共价键 2021-02-01 …
梧州市某校化学兴趣小组在实验室想制备CO2,因硫酸钙微溶于水,所以实验室中常用石灰石和稀盐酸制取CO 2021-02-06 …