早教吧作业答案频道 -->化学-->
铁元素不仅可以与SCN-、CN-等离子形成配合物,还可以与CO、NO等分子以及许多有机试剂形成配合物.回答下列问题:(1)基态铁原子有个未成对电子,Fe2+的电子排布式为,常用SCN-检验Fe
题目详情
铁元素不仅可以与SCN-、CN-等离子形成配合物,还可以与CO、NO等分子以及许多有机试剂形成配合物.回答下列问题:
(1)基态铁原子有___个未成对电子,Fe2+的电子排布式为___,常用SCN-检验Fe2+,二者可按n:1(n=1~5)的个数比形成血红色配合物,该配合物的化学式用通式表示为___
(2)CN-有毒,含CN-的工业废水必须处理,用TiO2作光催化剂可将废水中的CN-转化为OCN-,并最终氧化为N2、CO2
①C、N、O三种元素的第一电离能由大到小的顺序是___
②与CN-互为等电子体的一种分子为___(填化学式)1molFe(CN)32-中含有e键的数目为___
③铁与CO形成的配合物Fe(CO)3的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)3晶体属于___(填晶体类型)
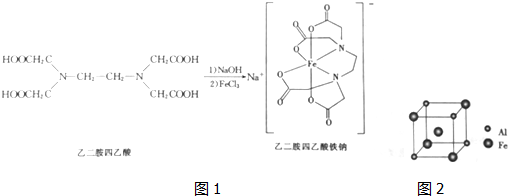
(3)乙二胺四乙酸能和Fe2+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如下:
①乙二胺四乙酸中碳原子的杂化轨道类型是___
②乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小沐星立方结构堆磅而成,小立方体如图所示,则该合金的化学式为___,已知小立方体边长为0.289mm,此铁铝合金的密度为___k•cm-3.

(1)基态铁原子有___个未成对电子,Fe2+的电子排布式为___,常用SCN-检验Fe2+,二者可按n:1(n=1~5)的个数比形成血红色配合物,该配合物的化学式用通式表示为___
(2)CN-有毒,含CN-的工业废水必须处理,用TiO2作光催化剂可将废水中的CN-转化为OCN-,并最终氧化为N2、CO2
①C、N、O三种元素的第一电离能由大到小的顺序是___
②与CN-互为等电子体的一种分子为___(填化学式)1molFe(CN)32-中含有e键的数目为___
③铁与CO形成的配合物Fe(CO)3的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)3晶体属于___(填晶体类型)
(3)乙二胺四乙酸能和Fe2+形成稳定的水溶性配合物乙二胺四乙酸铁钠,原理如下:
①乙二胺四乙酸中碳原子的杂化轨道类型是___
②乙二胺(H2NCH2CH2NH2)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___
(4)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小沐星立方结构堆磅而成,小立方体如图所示,则该合金的化学式为___,已知小立方体边长为0.289mm,此铁铝合金的密度为___k•cm-3.
▼优质解答
答案和解析
(1)基态铁原子的核外电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 4s2,3d6中,最多容纳10个电子,现在有6个,先占据单个的,所以只有2个成对,还有4个未成对;
铁原子失去两个电子变为二价铁离子,其电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 ;
依据化合价代数和为0可知:硫氰合铁通式为:[Fe(SCN)n](3-n)+;
故答案为:4;1s2 2s2 2p6 3s2 3p6 3d6 ;:[Fe(SCN)n](3-n)+;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
故答案为:N>O>C;
②与CN-互为等电子体的一种分子中有2个原子且价电子数为10,可以是CO;
1molFe(CN)63-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个CN-与铁离子形成6个配位键,所以共用12个σ键,1molFe(CN)32-中含有σ键数为12mol,个数为:12NA;
故答案为:CO;12NA;
③Fe(CO)3的熔沸点低,且易溶于四氯化碳,依据分子晶体熔沸点低,且存在相似相溶原理,可知Fe(CO)3为分子晶体;
故答案为:分子晶体;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
故答案为:sp2、sp3;
②乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以乙二胺(H2NCH3CH2NH3)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多;
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)依据铁铝合金晶胞结构铝原子的数目为4×
=
;铁原子数目为1+4×
=
,所以铝原子与铁原子个数之比为1:3,该铁铝合金的化学式为:AlFe3;
一个小立方体质量为
+
=161.96×10-23g;
所以其密度=
═
=6.71g/cm3;
故答案为:AlFe3;6.71;
铁原子失去两个电子变为二价铁离子,其电子排布为:1s2 2s2 2p6 3s2 3p6 3d6 ;
依据化合价代数和为0可知:硫氰合铁通式为:[Fe(SCN)n](3-n)+;
故答案为:4;1s2 2s2 2p6 3s2 3p6 3d6 ;:[Fe(SCN)n](3-n)+;
(2)①同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
故答案为:N>O>C;
②与CN-互为等电子体的一种分子中有2个原子且价电子数为10,可以是CO;
1molFe(CN)63-中CN含有C、N三键,其中1个是σ键,N原子有孤对电子,铁原子有空轨道,所以每个CN-与铁离子形成6个配位键,所以共用12个σ键,1molFe(CN)32-中含有σ键数为12mol,个数为:12NA;
故答案为:CO;12NA;
③Fe(CO)3的熔沸点低,且易溶于四氯化碳,依据分子晶体熔沸点低,且存在相似相溶原理,可知Fe(CO)3为分子晶体;
故答案为:分子晶体;
(3)①乙二胺四乙酸中碳原子为-CH2-,-COOH,前者碳原子以单键连接4个原子为四面体结构,为sp3杂化,-COOH中碳原子含有1个双键,为sp2杂化;
故答案为:sp2、sp3;
②乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键,所以乙二胺(H2NCH3CH2NH3)和三甲胺[N(CH3)2]均属于胺,但乙二胺比三甲胺的沸点高得多;
故答案为:乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)依据铁铝合金晶胞结构铝原子的数目为4×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 3 |
| 2 |
一个小立方体质量为
| 27 |
| 2×6.02×1023 |
| 56×3 |
| 2×6.02×1023 |
所以其密度=
| m |
| V |
| 161.96×10-23g |
| 0.0289×0.0289×0.0289cm3 |
故答案为:AlFe3;6.71;
看了 铁元素不仅可以与SCN-、C...的网友还看了以下:
某种氯氟烃(以m代替其化学式)可破坏臭氧层,其反应过程可表示为:m+O3→mO+O2,mO+O→m 2020-05-14 …
某种氯氟烃(以m代替其化学式)可破坏臭氧层,其反应过程可表示为:m+O3→mO+O2,mO+O→m 2020-05-14 …
(2011•崇明县二模)某种氟氯烃(以A代替其化学式)可破坏臭氧层,其反应过程可表示为A+O3→A 2020-05-17 …
现有Na、O、C、H五种元素,请选用其中一种或几种元素写出符合下列要求的化学式各一个:(1)碘酒中 2020-06-12 …
有机物G是一种高分子化合物,常用作有机合成的中间体,也适用于织物、皮革、纸张的处理剂,胶黏剂,以及 2020-06-12 …
如图所示在等腰三角行ABC中,AB=AC,角BAC=50度,角BAC的平分线与AB的中垂线交于点O 2020-07-09 …
某种氯氟烃(以m代替其化学式)可破坏臭氧层,其反应过程可表示为:m+O3→mO+O2,mO+O→m+ 2020-11-03 …
冰箱制冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应Cl+O3→ClO+O2,ClO+ 2020-11-28 …
下列有关杀虫剂的说法中,正确的是()A.所有杀虫剂是人工合成化学药剂B.一般的化学杀虫剂中含有P、S 2020-12-01 …
多肽合成中溶剂的纯度?多肽合成中涉及的试剂有(以固相合成为例):原料类:氨基酸树脂活化剂/缩合剂等溶 2021-01-13 …