早教吧作业答案频道 -->化学-->
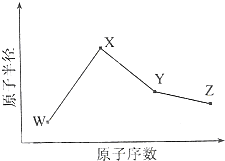
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的
题目详情
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
(1)X位于元素周期表中___;
(2)W的基态原子核外有___ 个未成对电子;
(3)Y的单质和Z单质相比,较活泼的是___(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___(写化学式);
(4)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是___;
(5)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是___.

(1)X位于元素周期表中___;
(2)W的基态原子核外有___ 个未成对电子;
(3)Y的单质和Z单质相比,较活泼的是___(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___(写化学式);
(4)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是___;
(5)在25°C、101kPa下,已知Y的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是___.
▼优质解答
答案和解析
W、X、Y、Z是四种常见的短周期元素,原子半径X>Y>Z>W;W的一种核素的质量数为18,中子数为10,其质子数为8,则W是O元素;
X和Ne原子的核外电子数相差1,其原子半径最大,为Na元素;
Y的单质是一种常见的半导体材料,则Y是Si元素;
Z的电负性在同周期主族元素中最大,且其原子半径大于O元素,则Z是Cl元素;
(1)X是Na元素,Na原子核外有3个电子层、最外层电子数为1,所以位于第三周期第IA族,故答案为:第三周期第IA族;
(2)W是O元素,其核外电子排布式为:1s22s22p4,其原子核外有2个未成对电子,故答案为:2;
(3)Y是Si元素、Z是Cl元素,同一周期元素,元素的非金属性随着原子序数增大而增强,元素的非金属性越强,其单质的活泼性越强,所以Y单质和Z单质相比,较活泼的是Cl2,元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>Br,所以氢化物较稳定的是HCl;
故答案为:Cl2;HCl;
(4)Y是Si元素、Z是Cl元素,二者形成的物质是四氯化硅,四氯化硅和水反应生成硅酸和HCl,反应方程式为SiCl4+3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
(4)Y的氢化物是硅烷,硅烷和氧气反应方程式为SiH4+2O2=SiO2+2H2O,该反应中转移电子数为8,平均每转移1mol 电子放热190.0kJ,则转移8mol电子放出热量1520.0KJ,则其热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol.
X和Ne原子的核外电子数相差1,其原子半径最大,为Na元素;
Y的单质是一种常见的半导体材料,则Y是Si元素;
Z的电负性在同周期主族元素中最大,且其原子半径大于O元素,则Z是Cl元素;
(1)X是Na元素,Na原子核外有3个电子层、最外层电子数为1,所以位于第三周期第IA族,故答案为:第三周期第IA族;
(2)W是O元素,其核外电子排布式为:1s22s22p4,其原子核外有2个未成对电子,故答案为:2;
(3)Y是Si元素、Z是Cl元素,同一周期元素,元素的非金属性随着原子序数增大而增强,元素的非金属性越强,其单质的活泼性越强,所以Y单质和Z单质相比,较活泼的是Cl2,元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>Br,所以氢化物较稳定的是HCl;
故答案为:Cl2;HCl;
(4)Y是Si元素、Z是Cl元素,二者形成的物质是四氯化硅,四氯化硅和水反应生成硅酸和HCl,反应方程式为SiCl4+3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
(4)Y的氢化物是硅烷,硅烷和氧气反应方程式为SiH4+2O2=SiO2+2H2O,该反应中转移电子数为8,平均每转移1mol 电子放热190.0kJ,则转移8mol电子放出热量1520.0KJ,则其热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0KJ/mol.
看了W、X、Y、Z是四种常见的短周...的网友还看了以下:
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电 2020-04-08 …
离子:阳离子:核电荷数(Z)=核内质子数(Z)=核外电子数+n,核外电子数+n是什么意思 2020-04-09 …
A元素原子的核电荷数为11,B元素原子的质子数为8,A和B化合形成化合物Z,下列说法中错误的是() 2020-06-18 …
三个原子核X、Y、Z,X核放出一个正电子后变为Y核,Y核与质子发生核反应后生成Z核并放出一个个氦( 2020-07-29 …
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为1 2020-11-08 …
a元素原子的核电荷数为11,b元素的核内质子数为8,A和B形成化合物Z,下列说法中错误的是()A.A 2020-11-18 …
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的内层电子数相 2021-01-05 …
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子 2021-01-05 …
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子 2021-01-05 …
有XYZ三种元素X原子核内有12个质子X元素和Z元素可形成XZ其中Z原子的核外电子数比X原子核外电子 2021-02-01 …