早教吧作业答案频道 -->化学-->
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关.(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍
题目详情
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关.
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍.具体反应为:Ni(s)+4CO(g)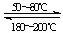 Ni(CO)4(g)
Ni(CO)4(g)
该反应的△H___0(选填“>”或“=”或“<”.
(2)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H1
有已知:H2O(1)═H2O(g)△H2
CO(g)+H 2 O(g)⇌CO2(g)+H2(g)△H3
工业上也可利用CO2与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(1)△H
则:△H与△H1、△H2、△H3之间的关系是:△H=___.
(3)-定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)
下列选项能判断该反应达到平衡状态的依据的有___.
A.2v(H2)=v (CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+2H2(g)⇌CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(p)的关系如(图1)所示.
①合成甲醇的反应为___(填“放热”或“吸热”)反应.
②A、B、C三点的平衡常数Ka、Kb、Kc的大小关系 为___.
③若达到平衡状态A时,容器的体积为10L,则在平衡 状态B时容器的体积为___L.
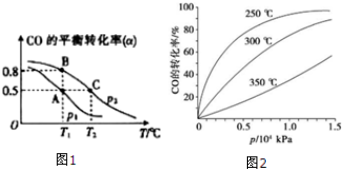
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如 (图2)所示,实际生产时条件控制在250°C、1.3×104kPa左右,选择此压强的理由是___.
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍.具体反应为:Ni(s)+4CO(g)
 Ni(CO)4(g)
Ni(CO)4(g)该反应的△H___0(选填“>”或“=”或“<”.
(2)工业上可利用CO生产乙醇:
2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H1
有已知:H2O(1)═H2O(g)△H2
CO(g)+H 2 O(g)⇌CO2(g)+H2(g)△H3
工业上也可利用CO2与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(1)△H
则:△H与△H1、△H2、△H3之间的关系是:△H=___.
(3)-定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)⇌CH3OCH3(g)+H2O(g)
下列选项能判断该反应达到平衡状态的依据的有___.
A.2v(H2)=v (CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+2H2(g)⇌CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(p)的关系如(图1)所示.
①合成甲醇的反应为___(填“放热”或“吸热”)反应.
②A、B、C三点的平衡常数Ka、Kb、Kc的大小关系 为___.
③若达到平衡状态A时,容器的体积为10L,则在平衡 状态B时容器的体积为___L.
④CO的平衡转化率(α)与温度(T)、压强(p)的关系如 (图2)所示,实际生产时条件控制在250°C、1.3×104kPa左右,选择此压强的理由是___.

▼优质解答
答案和解析
(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,故该反应正反应为放热反应,即△H<0,故答案为:<;
(2)已知:①2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,
故答案为:H=△H1-3△H2-2△H3;
(3)A.2v(H2)=v (CO)中未指明正逆速率,不能说明得到平衡,故A错误;
B.CO的消耗速率等于CH3OCH3的生成速率,均表示正反应速率,不能说明到达平衡,故B错误;
C.容器体积不变,随反应进行气体物质的量减小,压强减小,容器内的压强保持不变,说明到达平衡,故C正确;
D.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,故D错误;
E.混合气体总质量不变,随反应进行气体物质的量减小,混合气体平均相对分子质量减小,当混合气体的平均相对分子质量不随时间而变化,说明反应到达平衡,故E正确,
故答案为:CE;
(4)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则Ka=Kb,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故Kb>Kc,故Ka=Kb>Kc,
故答案为:Ka=Kb>Kc;
③A、B两点温度相等,压强不同,平衡常数相同,
对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)⇌CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=
=1
对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)⇌CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则
=1,解得V=2
故答案为:2;
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,
故答案为:在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失.
(2)已知:①2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,
故答案为:H=△H1-3△H2-2△H3;
(3)A.2v(H2)=v (CO)中未指明正逆速率,不能说明得到平衡,故A错误;
B.CO的消耗速率等于CH3OCH3的生成速率,均表示正反应速率,不能说明到达平衡,故B错误;
C.容器体积不变,随反应进行气体物质的量减小,压强减小,容器内的压强保持不变,说明到达平衡,故C正确;
D.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,故D错误;
E.混合气体总质量不变,随反应进行气体物质的量减小,混合气体平均相对分子质量减小,当混合气体的平均相对分子质量不随时间而变化,说明反应到达平衡,故E正确,
故答案为:CE;
(4)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则Ka=Kb,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故Kb>Kc,故Ka=Kb>Kc,
故答案为:Ka=Kb>Kc;
③A、B两点温度相等,压强不同,平衡常数相同,
对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)⇌CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=
| ||||
|
对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)⇌CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则
| ||||
|
故答案为:2;
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,
故答案为:在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失.
看了CO是现代化工生产的基础原料,...的网友还看了以下:
化工生产中常常用到“三酸两碱”、“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱.(1)(1)从物 2020-05-12 …
海水是巨大的资源宝库.如图1是从海水中提取食盐和溴的主要流程.(1)粗盐除含NaCl外,还含有少量 2020-05-17 …
阅读下面的《论语》选段,回答问题。(6分)子曰:“麻冕,礼也;今也纯(1),俭,吾从众。拜下(2) 2020-06-20 …
图8是某地海岸等高线地形图(等高距为50米)。据此判断问题。小题1:如果纯从避风的角度来看,图中四 2020-07-08 …
如图1是从不同类型酵母菌的发酵液中提取植酸酶的工艺流程,据图回答:(1)植酸酶(Ⅰ/Ⅱ)属于分泌蛋 2020-07-25 …
酿酒厂常用酸性脲酶去除酒精类饮品中的尿素,以改善酒精类饮品的品质.请回答下列问题:(1)从土壤中筛选 2020-11-02 …
纯碱既可以从内陆湖提取,又可用“侯氏联合制碱法”生产,其生产工艺流程可简要表示如图所示,其中沉淀池中 2020-11-03 …
以下命题:(1)z-.z是纯虚数(2)z1+z2∈R⇔z1=.z2(3)z1-z2>0⇔z1>z2( 2020-11-06 …
请沿用科学家认识事物的方法认识“空气”.(1)从分类角度:空气属于(填“混合物”或“纯净物”)(2) 2020-12-04 …
(1)从自然菌样中筛选较理想生产菌种的一般步骤是:采集菌样→富集培养→纯种分离→性能测定.请回答筛选 2021-01-01 …