早教吧作业答案频道 -->化学-->
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小.查阅资料知2NO(g)+O
题目详情
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)⇌2NO2(g)的速率却随着温度的升高而减小.查阅资料知
2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)△H1<0
②N2O2(g)+O2(g)⇌2NO2(g)(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)△H2<0
请回答下列问题:
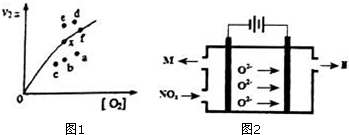
(1)反应2NO(g)+O2(g)⇌2NO2(g)的△H=___(用含△H1和△H2的式子表示).一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___,升高温度,K值___(填“增大”、“减小”或“不变”).
(2)决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”).
由实验数据得到v2正~c(O2)的关系可用图1表示.当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___(填字母).
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3•H2O=NH4NO3+NH4NO2+H2O.若反应后的溶液滴入甲基橙呈红色,则反应后溶液呈___性,且c(NH4+)___c(NO3-)+c(NO2-)(填“>”“<”或“=”).
(4)工业上也可用电解法处理氮氧化物(用NOX表示)的污染.电解池如图2所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-.该电解池阴极的电极反应式是___.阳极产生的气体N的化学式是___.
(5)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol•L-1)时,c(NO2-)=___.
2NO(g)+O2(g)⇌2NO2(g)的反应历程分两步:
①2NO(g)⇌N2O2(g)(快) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)△H1<0
②N2O2(g)+O2(g)⇌2NO2(g)(慢) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)△H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)⇌2NO2(g)的△H=___(用含△H1和△H2的式子表示).一定温度下,反应2NO(g)+O2(g)⇌2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___,升高温度,K值___(填“增大”、“减小”或“不变”).
(2)决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1___E2(填“>”、“<”或“=”).
由实验数据得到v2正~c(O2)的关系可用图1表示.当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___(填字母).
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3•H2O=NH4NO3+NH4NO2+H2O.若反应后的溶液滴入甲基橙呈红色,则反应后溶液呈___性,且c(NH4+)___c(NO3-)+c(NO2-)(填“>”“<”或“=”).
(4)工业上也可用电解法处理氮氧化物(用NOX表示)的污染.电解池如图2所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-.该电解池阴极的电极反应式是___.阳极产生的气体N的化学式是___.
(5)某温度时,亚硝酸银AgNO2的 Ksp=9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol•L-1)时,c(NO2-)=___.
▼优质解答
答案和解析
(1))①2NO(g)⇌N2O2(g);②N2O2(g)+O2(g)⇌2NO2(g),而目标反应2NO(g)+O2(g)⇌2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=
=
,而正反应是放热反应,所以升高温度,平衡常数减小,
故答案为:△H1+△H2;
;减小;
(2)因为决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;a;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性,c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-),
故答案为:酸;<;
(4)O2-在阳极发生氧化反应生成氧气,所以气体N为O2,而氮的氧化物在阴极发生还原反应生成氮气,阴极的电极反应式:2NOx+4xe-=N2+2xO2-,
故答案为:2NOx+4xe-=N2+2xO2-;O2;
(5)当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀,根据Ag2SO4的Ksp=4.0×10-5,此时银离子浓度=
=2.0,
c(NO2-)=
=4.5×10-4 mol•L-1,故答案为:4.5×10-4 mol•L-1.
| c2(NO2) |
| c(N2O2)c(O2) |
| K1正K2正 |
| K1逆K2逆 |
故答案为:△H1+△H2;
| K1正K2正 |
| K1逆K2逆 |
(2)因为决定2NO(g)+O2(g)⇌2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;a;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性,c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-),
故答案为:酸;<;
(4)O2-在阳极发生氧化反应生成氧气,所以气体N为O2,而氮的氧化物在阴极发生还原反应生成氮气,阴极的电极反应式:2NOx+4xe-=N2+2xO2-,
故答案为:2NOx+4xe-=N2+2xO2-;O2;
(5)当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀,根据Ag2SO4的Ksp=4.0×10-5,此时银离子浓度=
|
c(NO2-)=
| 9.0×10-4 |
| 2.0 |
看了研究氮氧化物的反应机理,对于消...的网友还看了以下:
对于达到平衡的化学反应:C(s)+H2O(g)⇌CO(g)+H2(g)(正反应为吸热反应),下列叙 2020-04-25 …
在恒容条件下,能使NO2(g)+CO(g)⇌CO2(g)+NO(g)正反应速率增大且活化分子的百分 2020-05-16 …
条件是恒温,恒容★若反应后气体体积减小,如2NO2(g)===N2O4(g)增加NO2的浓度,平衡 2020-05-16 …
用滑轮组加速提升重物,机械效率如何计算用滑轮组加速提升重物,绳子端施加的力为F,重物重为G,上升距 2020-06-02 …
对于2A(g)+B(g)2C(g);ΔH=-Q(Q>0),当温度升高时,平衡向逆反应方向移动,其原 2020-07-14 …
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2N 2020-11-21 …
Ⅰ.升温一定会使化学反应速率增大吗?如果是可逆反应的话升温的话会不会出现逆反应的速率超过或等于正反应 2020-12-09 …
已知反应A2(g)+2B2(g)2AB2(g)的ΔH<0,下列说法正确的是()A.升高温度,正向反应 2020-12-15 …
某温度下,对可逆反应2X(g)+Y(g)===Z(g)+W(s)为吸热反应则下列叙述正确的是A·加入 2020-12-25 …
对可逆反应N2(g)+3H2(g)⇌2NH3(g),△H=-92.4kJ•mol-1下列叙述正确的是 2021-01-22 …