早教吧作业答案频道 -->化学-->
稳定的ClO2易溶于水,熔点为一59.5℃,沸点为11℃,能在碱性条件下与H2O2反应,生成ClO2.它是国际公认的新一代高效、广谱、安全杀菌保鲜剂.但液态二氧化氯不稳定,易爆炸,在生产、包
题目详情
稳定的ClO2易溶于水,熔点为一59.5℃,沸点为11℃,能在碱性条件下与H2O2反应,生成ClO2.它是国际公认的新一代高效、广谱、安全杀菌保鲜剂.但液态二氧化氯不稳定,易爆炸,在生产、包装、运输方面不便.固载二氧化氯是用化学方法固化在载体上,使用时再释放出来.工业上NaClO2是制备稳定型固载ClO2的主要原料,采用H2O2、NaClO3和NaOH等制备NaClO2的工艺装置如图: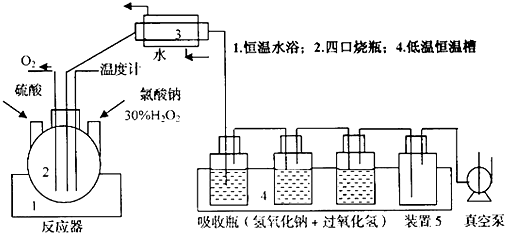
(1)反应器发生的化学反应方程式为___
(2)装置3的名称为___
A.离心机 B.冷凝器 C.安全器 D.电热器
(3)吸收瓶中发生的化学方程式为:___,为什么恒温槽要选择低温:___,还可以选择什么条件促进吸收:___
(4)装置5的作用是:___
(5)工业上可用如下方法对NaClO2纯度进行测定:
a称量约mg亚氯酸钠,配成500.00mL溶液
b.量取25.00mL试液,置于预先加有碘化钾溶液的碘量瓶中,并加入人适量稀硫酸溶液,摇匀,并于暗处放置10min
c.加100mL水,加人淀粉指示液,用浓度为c mol/L硫代硫酸钠标准溶液滴定至溶液蓝色消失即为终点,记下消耗的硫代硫酸钠标准溶液的体积为v mL,同时做空白试验,记下消耗的硫代硫酸钠标准溶液的体积为V0mL.滴定发生的方程式:2Na2S2O3+I2=2NaI+Na2S4O6 4I-+ClO2-+4H+=2I2+Cl-+3H2O
利用上述数据写出NaClO2质量分数的计算式(不用化简)___
(6)工业上可用RS(kesting法,原理为:2NaClO3+4HCl=2ClO2+Cl2↑+2NaCl+2H2O)制ClO2,相比R5法,过氧化氢法有什么优点___.

(1)反应器发生的化学反应方程式为___
(2)装置3的名称为___
A.离心机 B.冷凝器 C.安全器 D.电热器
(3)吸收瓶中发生的化学方程式为:___,为什么恒温槽要选择低温:___,还可以选择什么条件促进吸收:___
(4)装置5的作用是:___
(5)工业上可用如下方法对NaClO2纯度进行测定:
a称量约mg亚氯酸钠,配成500.00mL溶液
b.量取25.00mL试液,置于预先加有碘化钾溶液的碘量瓶中,并加入人适量稀硫酸溶液,摇匀,并于暗处放置10min
c.加100mL水,加人淀粉指示液,用浓度为c mol/L硫代硫酸钠标准溶液滴定至溶液蓝色消失即为终点,记下消耗的硫代硫酸钠标准溶液的体积为v mL,同时做空白试验,记下消耗的硫代硫酸钠标准溶液的体积为V0mL.滴定发生的方程式:2Na2S2O3+I2=2NaI+Na2S4O6 4I-+ClO2-+4H+=2I2+Cl-+3H2O
利用上述数据写出NaClO2质量分数的计算式(不用化简)___
(6)工业上可用RS(kesting法,原理为:2NaClO3+4HCl=2ClO2+Cl2↑+2NaCl+2H2O)制ClO2,相比R5法,过氧化氢法有什么优点___.
▼优质解答
答案和解析
(1)根据工艺装置图中物质的信息可知,反应物为H2O2、H2SO4和NaClO3,生成物为ClO2,氯的化合价降低,过氧化氢中-1价的氧化合价升高,所以产物中有氧气,根据得失电子守恒和原子守恒,反应方程式为:2NaClO3+H2O2+H2SO4=2ClO2+O2↑+Na2SO4+2H2O,
故答案为:2NaClO3+H2O2+H2SO4=2ClO2+O2↑+Na2SO4+2H2O;
(2)装置3从下向上进水,ClO2易溶于水,熔点为-59.5℃,沸点为11℃,所以装置3为冷凝装置,
故答案为:B;
(3)吸收瓶中二氧化氯和过氧化氢在碱性条件下反应:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2,温度过高,过氧化氢会分解,所以选择低温条件,也可选择增大反应物氢氧化钠的浓度促进吸收,
故答案为:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2;温度过高,过氧化氢会分解;增大氢氧化钠的浓度;
(4)装置5处在吸收瓶和真空泵之间,起缓冲作用,防止吸收液直接进入真空泵,
故答案为:缓冲,防止吸收液直接进入真空泵;
(5)根据c步骤.滴定发生的方程式:2Na2S2O3+I2=2NaI+Na2S4O6,2Na2S2O3~I2反应生成的碘单质的物质的量为:n(I2)=
n(Na2S2O3)=
×C×(V-V0)×10-3mol/L,
由4I++ClO2-+4H+=2I2+Cl-+3H2O可知ClO2-~2I2,步骤a.称量约mg亚氯酸钠,配成500.00mL溶液,n(NaClO2)=
n(I2)=
×C×
×(V-V0)×10-3mol/L,
所以NaClO2的质量为:m(NaClO2)=nM=
×C×
×(V-V0)×10-3mol/L×90.5g/mol═
×C×
×(V-V0)×10-3×90.5g,所以NaClO2的质量分数为:
×100%,
故答案为:
×100%;
(6)制备NaClO2的工艺未使用易挥发的酸,没有易挥发的污染物,而用R5(kesting法,原理为:2NaClO3+4HCl=2ClO2+Cl2↑+2NaCl+2H2O)制ClO2,氯气、氯化氢有毒且易挥发,对环境污染大,所以相比R5法,过氧化氢对环境污染小,
故答案为:对环境污染小.
故答案为:2NaClO3+H2O2+H2SO4=2ClO2+O2↑+Na2SO4+2H2O;
(2)装置3从下向上进水,ClO2易溶于水,熔点为-59.5℃,沸点为11℃,所以装置3为冷凝装置,
故答案为:B;
(3)吸收瓶中二氧化氯和过氧化氢在碱性条件下反应:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2,温度过高,过氧化氢会分解,所以选择低温条件,也可选择增大反应物氢氧化钠的浓度促进吸收,
故答案为:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2;温度过高,过氧化氢会分解;增大氢氧化钠的浓度;
(4)装置5处在吸收瓶和真空泵之间,起缓冲作用,防止吸收液直接进入真空泵,
故答案为:缓冲,防止吸收液直接进入真空泵;
(5)根据c步骤.滴定发生的方程式:2Na2S2O3+I2=2NaI+Na2S4O6,2Na2S2O3~I2反应生成的碘单质的物质的量为:n(I2)=
| 1 |
| 2 |
| 1 |
| 2 |
由4I++ClO2-+4H+=2I2+Cl-+3H2O可知ClO2-~2I2,步骤a.称量约mg亚氯酸钠,配成500.00mL溶液,n(NaClO2)=
| 1 |
| 2 |
| 1 |
| 4 |
| 500 |
| 25 |
所以NaClO2的质量为:m(NaClO2)=nM=
| 1 |
| 4 |
| 500 |
| 25 |
| 1 |
| 4 |
| 500 |
| 25 |
(V-V0)×C×
| ||
m×
|
故答案为:
(V-V0)×C×
| ||
m×
|
(6)制备NaClO2的工艺未使用易挥发的酸,没有易挥发的污染物,而用R5(kesting法,原理为:2NaClO3+4HCl=2ClO2+Cl2↑+2NaCl+2H2O)制ClO2,氯气、氯化氢有毒且易挥发,对环境污染大,所以相比R5法,过氧化氢对环境污染小,
故答案为:对环境污染小.
看了稳定的ClO2易溶于水,熔点为...的网友还看了以下:
2012年3月31日18时37分,我国在西昌卫星发射中心用“长征三号”运载火箭,将亚太7号通信卫星 2020-05-17 …
清晨草地上有一层薄薄的霜,则夜里的气温一定低于/高于/等于0℃低于还是高于还是等于 2020-05-23 …
求函数在指定点的高阶导数f(x)=x/根号下(1+x^2),求f''(0) 2020-06-06 …
在摄氏温标中,低定点和高定点分别是什么?这两个温度是怎样定出的? 2020-06-10 …
一个人下班后到指定地点有他的妻子从家开车接他回家.某一天,他提前30分钟到达指定点,于是他沿妻子接 2020-06-24 …
材料:日凌现象主要是太阳,人造卫星,地球上地面卫星接收站,正好处于一条直线上产生的,此时,太阳发出 2020-07-03 …
绘制地形剖面图时遇到陡崖怎么确定点的高度计算陡崖的高度得80≤h<320,应该怎么取值呢 2020-07-12 …
小米公司正式成立2010年4月,是一家专注②智能手机自主研发的移动互联网公司,定位于高性能发烧手机 2020-08-01 …
小米公司正式成立于2010年4月,是一家专注智能手机自主研发的移动互联网公司,定位于高性能发烧手机 2020-08-01 …
近地卫星距地面高度是地球半径的多少倍10.2010年1月22日1时47分,北斗星导航系统第三颗组网卫 2020-12-01 …