早教吧作业答案频道 -->化学-->
“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题.(1)已知:CO2(g)+2H2(g)⇌C(s)+2H2O(g)△H=-90.0kJ•mol-1H2O(1)═H2O(g)△H=+44.0kJ•mol-1C(s)的燃烧热△H=-394.0
题目详情
“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题.
(1)已知:
CO2(g)+2H2(g)⇌C(s)+2H2O(g)△H=-90.0kJ•mol-1
H2O(1)═H2O(g)△H=+44.0kJ•mol-1
C(s)的燃烧热△H=-394.0kJ•mol-1
则表示H2燃烧热的热化学方程式为___.
(2)在0.1MPa、Ru/TiO2催化下,将H2和CO2按投料比
=4:1置于恒压密闭容器中发生反应:
反应I CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H1
反应II CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2
测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示.
(选择性:转化的CO2中生成CH4或CO的百分比)
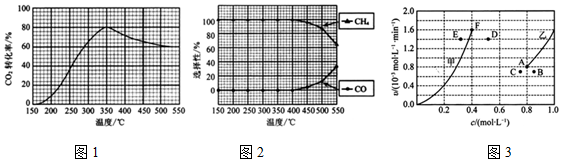
①反应I的△H1___ (填“>”、“<“或“=”)0;理由是___.
②温度过高或过低均不利于反应I的进行,原因是___.
③350℃时,反应I的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④为减少CO在产物中的比率,可采取的措施有___(列举一条).
(3)为探究反应I的反应速率与浓度的关系,向恒容密闭容器中通入浓度均为1.0mol•L-1的H2与CO2.根据相关数据绘制出反应速率与浓度关系曲线:v正~c(CO2)和v逆~c(H2O).则与曲线v正~c(CO2)相对应的是图3曲线___(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为___(填字母,下同),曲线乙对应的平衡点可能为___.
(1)已知:
CO2(g)+2H2(g)⇌C(s)+2H2O(g)△H=-90.0kJ•mol-1
H2O(1)═H2O(g)△H=+44.0kJ•mol-1
C(s)的燃烧热△H=-394.0kJ•mol-1
则表示H2燃烧热的热化学方程式为___.
(2)在0.1MPa、Ru/TiO2催化下,将H2和CO2按投料比
| n(H2) |
| n(CO2) |
反应I CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H1
反应II CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2
测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示.
(选择性:转化的CO2中生成CH4或CO的百分比)

①反应I的△H1___ (填“>”、“<“或“=”)0;理由是___.
②温度过高或过低均不利于反应I的进行,原因是___.
③350℃时,反应I的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④为减少CO在产物中的比率,可采取的措施有___(列举一条).
(3)为探究反应I的反应速率与浓度的关系,向恒容密闭容器中通入浓度均为1.0mol•L-1的H2与CO2.根据相关数据绘制出反应速率与浓度关系曲线:v正~c(CO2)和v逆~c(H2O).则与曲线v正~c(CO2)相对应的是图3曲线___(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为___(填字母,下同),曲线乙对应的平衡点可能为___.
▼优质解答
答案和解析
(1)①CO2(g)+2H2(g)⇌C(s)+2H2O(g)△H=-90.0kJ/mol
②H2O(1)═H2O(g)△H=+44.0kJ/mol
C(s)的燃烧热△H=-394.0kJ•mol-1,故热化学方程式为③C(s)+O2(g)=CO2(g)△H=-394.0kJ/mol
×①+
×③-②得,H2(g)+
O2(g)=H2O(l)△H=-286KJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-286KJ/mol;
(2)①反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故<0;原因是反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,
故答案为:<;反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应;
②温度过高或过低均不利于反应I的进行,原因是:温度过低,化学反应速率慢,温度过高反应Ⅰ向逆反应方向进行且CH4的选择性减小,
故答案为:温度过低,化学反应速率慢,温度过高反应Ⅰ向逆反应方向进行且CH4的选择性减小;
③CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
开始(n) 1 4 0 0
变化 0.8 3.2 0.8 1.6
平衡 0.2 0.8 0.8 1.6,则p(CO2)=
×0.1MPa=
MPa,p(H2)=
×0.1MPa=
MPa,p(CH4)=
×0.1MPa=
MPa,p(H2O)=
×0.1MPa=
MPa,则Kp=
=
=2.89×104(MPa)-2,
故答案为:2.89×104(MPa)-2;
④由图象得,为减少CO在产物中的比率,可采取的措施有降低温度或增加压强,
故答案为:降低温度或增加压强;
(3)CH4与CO2其起始的物质的量浓度均为1.0 mol•L-1,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,所以曲线v正-c(CH4)相对应的是如图3中曲线是乙线;根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,所以此时曲线甲对应的平衡点可能为应为D点;降温后,反应速率减小,平衡逆向移动,CO浓度减小,曲线乙对应的平衡点可能为C点,
故答案为:乙;D;C.
②H2O(1)═H2O(g)△H=+44.0kJ/mol
C(s)的燃烧热△H=-394.0kJ•mol-1,故热化学方程式为③C(s)+O2(g)=CO2(g)△H=-394.0kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(2)①反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故<0;原因是反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,
故答案为:<;反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应;
②温度过高或过低均不利于反应I的进行,原因是:温度过低,化学反应速率慢,温度过高反应Ⅰ向逆反应方向进行且CH4的选择性减小,
故答案为:温度过低,化学反应速率慢,温度过高反应Ⅰ向逆反应方向进行且CH4的选择性减小;
③CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)
开始(n) 1 4 0 0
变化 0.8 3.2 0.8 1.6
平衡 0.2 0.8 0.8 1.6,则p(CO2)=
| 0.2 |
| 0.2+0.8+0.8+1.6 |
| 1 |
| 170 |
| 0.8 |
| 0.2+0.8+0.8+1.6 |
| 4 |
| 170 |
| 0.8 |
| 0.2+0.8+0.8+1.6 |
| 4 |
| 170 |
| 1.6 |
| 0.2+0.8+0.8+1.6 |
| 8 |
| 170 |
| p(CH4)p2(H2O) |
| p(CO2)p4(H2) |
| ||||
|
故答案为:2.89×104(MPa)-2;
④由图象得,为减少CO在产物中的比率,可采取的措施有降低温度或增加压强,
故答案为:降低温度或增加压强;
(3)CH4与CO2其起始的物质的量浓度均为1.0 mol•L-1,且随着反应的进行,甲烷的浓度会越来越小,正反应速率也会越来越小,所以曲线v正-c(CH4)相对应的是如图3中曲线是乙线;根据图可知,反应平衡时图中对应的点应为A和F点,降温后,反应速率减小,平衡逆向移动,甲烷的浓度会增大,所以此时曲线甲对应的平衡点可能为应为D点;降温后,反应速率减小,平衡逆向移动,CO浓度减小,曲线乙对应的平衡点可能为C点,
故答案为:乙;D;C.
看了“低碳经济”备受关注,CO2的...的网友还看了以下:
下列不属于日本经济发展的有利条件是()A.丰富的矿产资源B.便利的海运C.发达的科技D.高素质的劳 2020-05-13 …
科技发展是利大还是弊大辩论会反方弊大辩论词正方是科技发展利大于弊,反方是弊大于利 2020-05-17 …
技术的进步源于科学的发展,科学家的辛勤工作和超常人的想象力是科学发展的源泉.丹麦科学家研究发现了电流 2020-11-11 …
上网已日益成为青少年学习科学文化知识、增长才干的有效手段。为防止未成年人受到不良诱惑,我国未成年人保 2020-11-15 …
上网已日益成为青少年学习科学文化知识、增长才干的有效手段.为防止未成年人受到不良诱惑,我国未成年人保 2020-11-15 …
低碳经济是一种以能源的清洁开发与高效利用为基础,以低能耗.低排放为基本经济特征的经济发展模式。提高企 2020-12-14 …
小明为提高成绩,提出了有效利用时间的建议,你认为正确的是()①珍惜每一个今天②留给薄弱学科多一点时间 2020-12-16 …
目前有效控制及高效利用CO、CO2的研究正引起全球广泛关注,根据《中国化工报》报道,美国科学家发现了 2020-12-18 …
"科技发展利与弊",六年级人教版的.学习了五单元,我校六年级的学生就“科技发展利与弊”举行了一场辩论 2021-02-02 …
辩论:高科技的发展的利弊试给出高科技的发展利大于弊的论据,注意道理论证与事实论证并用来阐述(越详细越 2021-02-02 …