早教吧作业答案频道 -->化学-->
氯化亚铜在工业上应用广泛.利用反应Cu2++Cu+2Cl-=2CuCl制氯化亚铜的流程如下图.氯化亚铜(CuC1)为白色晶体,不溶于硫酸、稀硝酸和醇,微溶于水,在空气中会被迅速氧化,能溶于浓盐酸,
题目详情
氯化亚铜在工业上应用广泛.利用反应Cu2++Cu+2Cl-=2CuCl制氯化亚铜的流程如下图.氯化亚铜(CuC1)为白色晶体,不溶于硫酸、稀硝酸和醇,微溶于水,在空气中会被迅速氧化,能溶于浓盐酸,并生成配合物,该配合物加水稀释后会重新析出CuCl沉淀.
实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为___.
(2)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的
目的是___.
(3)工业化生产时,乙醇可通过___方法回收并循环利用,而NH4Cl、___(填化学式)可直接循环利用.
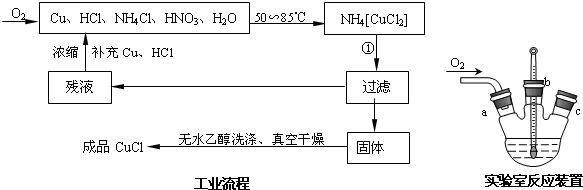
(4)实验室用如图装置制备CuCl.实验开始时,温度计显示反应液温度低于室温,主要原因是___,电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当___时才能停止通入氧气.
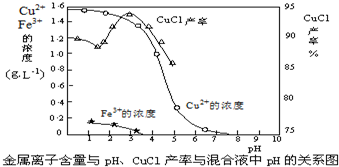
(5)氯化亚铜在工业上也可以利用酸性电镀废液(主要含Cu2+、Fe3+)制得高浓度硫酸铜溶液后,加入铁粉、氯化钠生成CuCl.反应的离子反应方程式为:___.
CuCl产率与混合液pH的关系如图,析出CuCl晶体时的最佳pH在___左右.

实验药品:铜丝20g、氯化铵20g、65% 硝酸10mL、36%盐酸15mL、水.
(1)反应①的化学方程式为___.
(2)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装.真空干燥,密封包装的
目的是___.
(3)工业化生产时,乙醇可通过___方法回收并循环利用,而NH4Cl、___(填化学式)可直接循环利用.
(4)实验室用如图装置制备CuCl.实验开始时,温度计显示反应液温度低于室温,主要原因是___,电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当___时才能停止通入氧气.
(5)氯化亚铜在工业上也可以利用酸性电镀废液(主要含Cu2+、Fe3+)制得高浓度硫酸铜溶液后,加入铁粉、氯化钠生成CuCl.反应的离子反应方程式为:___.
CuCl产率与混合液pH的关系如图,析出CuCl晶体时的最佳pH在___左右.

▼优质解答
答案和解析
(1)NH4[CuCl2]分解产物过滤后得到滤液为氯化铵,固体为CuCl,反应的化学方程式为NH4[CuCl2]=CuCl↓+NH4Cl,故答案为:NH4[CuCl2]=CuCl↓+NH4Cl;(2)由题给信息可知CuCl微溶于水,不溶于乙醇,在空气中会被迅速氧...
看了氯化亚铜在工业上应用广泛.利用...的网友还看了以下:
化学.求救在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmo 2020-04-12 …
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的 2020-05-13 …
下列溶液中,溶质的物质的量浓度为1mol⋅L−1的是()。A.将40gNaOH溶于1L水所得的溶液 2020-05-13 …
常温下下向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液 2020-05-13 …
高二化学求详细解释将 m mol/l的醋酸和n mol/l的氢氧化钠溶液等体积混合后溶液的PH 2020-05-13 …
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变 2020-05-14 …
高二化学:已知某酸H2A是强酸,实验表明0.1mol/L的H2A溶液中c(H+)=0.11ml/L 2020-05-24 …
0.1mol·L-1的某二元弱酸(H2X)溶液和0.1mol·L-1NaOH溶液等体积混合物(忽略 2020-07-25 …
下列各组数据前者刚好是后者的两倍为什么是B呢?D为什么又不是呢请详细解之B200ml1mol.L-1 2020-12-14 …
下列离子浓度关系正确的是()A.0.1mol•L-1的NH4Cl溶液中c(NH4+)=c(Cl-)B 2021-02-01 …