早教吧作业答案频道 -->化学-->
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.(1)Mg2Ni是一种储氢合金,已知:Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1Mg2Ni(s)+2H2(g
题目详情
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
则△H3=___kJ•mol-1.
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H2O转化为MgCl2•NH4Cl•nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为___;电解熔融氯化镁,阴极的电极反应式为___
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2+2A1+3H2↑每生成27gAl转移电子的物质的量为___
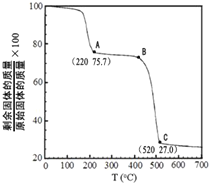
(4)工业上用MgC2O4•2H2O热分解制超细MgO,其热分解曲线如图.图中隔绝空气条件下B→C发生反应的化学方程式为___.

(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
则△H3=___kJ•mol-1.
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H2O转化为MgCl2•NH4Cl•nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为___;电解熔融氯化镁,阴极的电极反应式为___
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2+2A1+3H2↑每生成27gAl转移电子的物质的量为___
(4)工业上用MgC2O4•2H2O热分解制超细MgO,其热分解曲线如图.图中隔绝空气条件下B→C发生反应的化学方程式为___.
▼优质解答
答案和解析
(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6kJ/mol,则△H3=+84.6kJ/mol,
故答案为:+84.6;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式:MgCl2•NH4Cl•nNH3
MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
故答案为:MgCl2•NH4Cl•nNH3
MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol,
故答案为:3mol;
(4)工业上用MgC2O4•2H2O热分解制超细MgO,当最后固体完全为MgO时,剩余固体质量占原先固体质量的百分比为:
×100%=27%,所以C点剩余的固体为MgO,MgC2O4•2H2O加热后先失去结晶水,完全失去结晶水后生成MgC2O4时剩余固体质量占原先固体质量的百分比:1-
×100%≈75.7%,说明A点恰好失去结晶水,则B点剩余固体为氧化镁和草酸镁的混合物,草酸镁中C的化合价为+3价,根据氧化还原反应特点可知,草酸镁分解生成一氧化碳和二氧化碳气体,反应的化学方程式为:MgC2O4
MgO+CO↑+CO2↑,
故答案为:MgC2O4
MgO+CO↑+CO2↑.
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=-64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3=-64.4KJ/mol-2×(-74.5KJ/mol)=+84.6kJ/mol,则△H3=+84.6kJ/mol,
故答案为:+84.6;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式:MgCl2•NH4Cl•nNH3
| ||
故答案为:MgCl2•NH4Cl•nNH3
| ||
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol,
故答案为:3mol;
(4)工业上用MgC2O4•2H2O热分解制超细MgO,当最后固体完全为MgO时,剩余固体质量占原先固体质量的百分比为:
| 40 |
| 148 |
| 36 |
| 148 |
| ||
故答案为:MgC2O4
| ||
看了镁是海水中含量较多的金属,镁、...的网友还看了以下:
钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为:已知① 2020-04-07 …
12g合金,是钠镁铝锌中两种组成,与足量盐酸反应生成5.6l氢气(标)则一定含金属()(解释)大神 2020-04-26 …
[f(x)g(x)]'=f'(x)g(x)+f(x)g'(x)中的g(x)g‘(x)分别代表什么[ 2020-04-26 …
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电导线材料,B为黑色粉末,L是由两种元 2020-05-14 …
在一个溢水杯中装满水,并在溢水杯口下放一个小烧杯,如图所示,将一个体积为10cm3的金属块慢慢浸没 2020-05-17 …
f(x)/g(x)>m可推出[f(x)-mg(x)]*g(x)>0.他的g(x)怎么推出来f(x) 2020-05-17 …
将一个重为G的实心金属小球放入水中,静止时它对容器底部的压力是它受到浮力的四倍,求:(1)此金属球 2020-06-07 …
大一无机化学.下列反应中,△rHm与产物的△fHm相同的是a2H2(g)+O2(g)→2H2O(l 2020-06-11 …
在评奖会上,A、B、C、D、E、F、G、H竞争一项金奖.由一个专家小组投票,票数最多的将获金奖.如 2020-06-27 …
物理好的来看看把体积为1dm3次的空心金属球挂在弹簧秤上,浸没在水中静止时,弹簧秤的示数是放在空气 2020-06-30 …