早教吧作业答案频道 -->化学-->
以软锰矿(主要成份为MnO2和SiO2,含少量Al2O3)和闪锌矿(主要成份ZnS和SiO2,含少量FeS、CuS)为原料生产MnO2、锌及副产品Cu的工艺流程如下:(1)试剂X的化学式为.(2)已知MnO2具有强氧
题目详情
以软锰矿(主要成份为MnO2和SiO2,含少量Al2O3)和闪锌矿(主要成份ZnS和SiO2,含少量FeS、CuS)为原料生产MnO2、锌及副产品Cu的工艺流程如下:
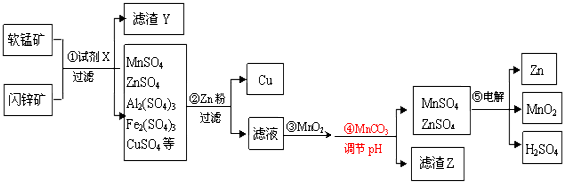
(1)试剂X的化学式为___.
(2)已知MnO2具有强氧化性,滤渣Y中含有一种单质,该单质是___;步骤③MnO2的作用是___.
(3)步骤②加Zn粉时,Zn与Fe2(SO4)3溶液反应的离子方程式为___.
(4)步骤④发生反应的离子方程式为___.
(5)已知:Ksp[ZnS]=2×10-22,Ksp[MnS]=2×10-10
Ksp[ZnCO3]=1.4×10-11,Ksp[MnCO3]=1.8×10-11
请利用上述数据,调节pH用MnCO3而不用MnS的原因是___.
(6)滤渣Z除MnCO3、ZnCO3外,主要成分为___.
(7)步骤⑤的电解产物Zn、MnO2、H2SO4的物质的量之比是___.

(1)试剂X的化学式为___.
(2)已知MnO2具有强氧化性,滤渣Y中含有一种单质,该单质是___;步骤③MnO2的作用是___.
(3)步骤②加Zn粉时,Zn与Fe2(SO4)3溶液反应的离子方程式为___.
(4)步骤④发生反应的离子方程式为___.
(5)已知:Ksp[ZnS]=2×10-22,Ksp[MnS]=2×10-10
Ksp[ZnCO3]=1.4×10-11,Ksp[MnCO3]=1.8×10-11
请利用上述数据,调节pH用MnCO3而不用MnS的原因是___.
(6)滤渣Z除MnCO3、ZnCO3外,主要成分为___.
(7)步骤⑤的电解产物Zn、MnO2、H2SO4的物质的量之比是___.
▼优质解答
答案和解析
(1)分析可知X为H2SO4,
故答案为:H2SO4;
(2)MnO2具有强氧化性,硫离子被也会为硫单质,滤渣Y中含有一种单质为S,步骤③MnO2的作用是将Fe2+氧化为Fe3+,
故答案为:S;将Fe2+氧化为Fe3+;
(3)步骤②加Zn粉时,Zn与Fe2(SO4)3溶液反应的离子方程式为:Zn+2Fe3+═Zn2++2Fe2+,
故答案为:Zn+2Fe3+═Zn2++2Fe2+;
(4)步骤④发生反应的离子方程式为:MnCO3+2H+═Mn2++CO2↑+H2O,
故答案为:MnCO3+2H+═Mn2++CO2↑+H2O;
(5)调节pH用MnCO3而不用MnS的原因是:Ksp[ZnS]=2×10-22,Ksp[MnS]=2×10-10,Ksp[ZnCO3]=1.4×10-11,Ksp[MnCO3]=1.8×10-11,硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀,
故答案为:硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀;
(6)滤渣Z除MnCO3、ZnCO3外,主要成分为Al(OH)3;Fe(OH)3,
故答案为:Al(OH)3;Fe(OH)3;
(7)电解MnSO4、ZnSO4混合溶液,阳极电极反应Mn2+-2e-+2H2O=MnO2+4H+,阴极电极反应为Zn2++2e-=Zn,电子守恒得到步骤⑤的电解产物Zn、MnO2、H2SO4的物质的量之比是1:1:2,
故答案为:1:1:2.
故答案为:H2SO4;
(2)MnO2具有强氧化性,硫离子被也会为硫单质,滤渣Y中含有一种单质为S,步骤③MnO2的作用是将Fe2+氧化为Fe3+,
故答案为:S;将Fe2+氧化为Fe3+;
(3)步骤②加Zn粉时,Zn与Fe2(SO4)3溶液反应的离子方程式为:Zn+2Fe3+═Zn2++2Fe2+,
故答案为:Zn+2Fe3+═Zn2++2Fe2+;
(4)步骤④发生反应的离子方程式为:MnCO3+2H+═Mn2++CO2↑+H2O,
故答案为:MnCO3+2H+═Mn2++CO2↑+H2O;
(5)调节pH用MnCO3而不用MnS的原因是:Ksp[ZnS]=2×10-22,Ksp[MnS]=2×10-10,Ksp[ZnCO3]=1.4×10-11,Ksp[MnCO3]=1.8×10-11,硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀,
故答案为:硫化锌的溶度积较小,若加入MnS调节pH时,可能会使锌离子转化成硫化锌沉淀;
(6)滤渣Z除MnCO3、ZnCO3外,主要成分为Al(OH)3;Fe(OH)3,
故答案为:Al(OH)3;Fe(OH)3;
(7)电解MnSO4、ZnSO4混合溶液,阳极电极反应Mn2+-2e-+2H2O=MnO2+4H+,阴极电极反应为Zn2++2e-=Zn,电子守恒得到步骤⑤的电解产物Zn、MnO2、H2SO4的物质的量之比是1:1:2,
故答案为:1:1:2.
看了以软锰矿(主要成份为MnO2和...的网友还看了以下:
例如2,3-二甲基戊烷."2,3-"为取代基位置;"二"为取代基数目;"甲基"为取代基名称;"戊烷 2020-05-02 …
如图所示,是中国MBT2000型主战坦克,是中国北方工业公司(NORINCO)研制、生产的面向21 2020-06-22 …
求1+2+2^2+2^3+2^4+…+2^2014的值.设S=1+2+2^2+2^3+2^4+…+ 2020-07-09 …
冥冥和玲玲在数学活动课上发现有这样的两个数,它们的和与积相等,如2+2=2×2,&frac冥冥和玲 2020-07-09 …
2的n次方求2的N次方的位数的公式如2^1=2(1)2^2=4(1)2^3=8(1)2^4=16( 2020-07-19 …
如何找出1^2+2^2+3^2+4^2.+n^2的generalterm,generalterm的 2020-07-22 …
如图是木本植物幼茎的横切面示意图.(1)[1],作用是由下向上运输.(2)[2],作用是由上向下运 2020-07-31 …
举6个例子2个是准确数:如人有2只手2个是精确数:如本市有52万人2个非用近似数不可的:如现在是2 2020-07-31 …
xyz=1,x+y+z=2,x^2+y^2+z^2=3,求x,y,z我解:xy=1/z,x+y=2- 2020-10-31 …
观察下列各式然后回答问题:1-1/2^2=1/2*2/3,1-1/3^2+2/3*4/3,1-1/4 2020-11-01 …