早教吧作业答案频道 -->化学-->
X、Y是元素周期表前20号元素,且X的原子序数比Y大4,请填空(X、Y要用具体的元素符号表示):Ⅰ、若X是短周期最活泼的金属元素.(1)25℃,用0.1000mol/L的XOH溶液滴定20.00mL0.1000mol/L某一
题目详情
X、Y是元素周期表前20号元素,且X的原子序数比Y大4,请填空(X、Y要用具体的元素符号表示):
Ⅰ、若X是短周期最活泼的金属元素.
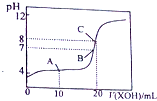
(1)25℃,用0.1000mol/L的XOH溶液滴定20.00mL
0.1000 mol/L某一元酸HA溶液所得滴定曲线如图.下列说法正确的是___
A.A、B、C三点所示溶液导电能力最强的是C点对应的溶液
B.在C点溶液中,c(H+)+c(HA)=c(OH-)
C.25℃,HA的电离平衡常数约为5.0×10-4
(2)一定条件下在体积不变的容器发生反应:2YO(g)+O2(g)⇌2YO2(g)
①该反应的平衡常数表达式K=___.
已知K300℃>K350℃,则该反应是___热反应.
②能说明该反应已达到平衡状态的是___
a.v(YO2)=2v(O2)
b.容器内压强保持不变
c.v逆(YO)=2v正(O2)
d.容器内密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是___
a.及时分离处YO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
Ⅱ、若X的离子半径是第三周期离子半径最小的
(3)已知在此温度下:
H+(aq)+OH-(aq)=H2O(I)△H=-aKJ/mol
HY(aq)⇌H+(aq)+Y-(aq)△H=+bKJ/mol
则HY和强碱稀溶液发生中和反应的热化学方程式为___.
(4)X的单质与某磁性氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为___
Ⅲ、若X为金属元素,Y为非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(5)含X的某盐与Y的气态氧化物都能做漂白剂,写出制备含X元素且具有漂白性的某盐的化学方程式___.
Ⅰ、若X是短周期最活泼的金属元素.

(1)25℃,用0.1000mol/L的XOH溶液滴定20.00mL
0.1000 mol/L某一元酸HA溶液所得滴定曲线如图.下列说法正确的是___
A.A、B、C三点所示溶液导电能力最强的是C点对应的溶液
B.在C点溶液中,c(H+)+c(HA)=c(OH-)
C.25℃,HA的电离平衡常数约为5.0×10-4
(2)一定条件下在体积不变的容器发生反应:2YO(g)+O2(g)⇌2YO2(g)
①该反应的平衡常数表达式K=___.
已知K300℃>K350℃,则该反应是___热反应.
②能说明该反应已达到平衡状态的是___
a.v(YO2)=2v(O2)
b.容器内压强保持不变
c.v逆(YO)=2v正(O2)
d.容器内密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是___
a.及时分离处YO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
Ⅱ、若X的离子半径是第三周期离子半径最小的
(3)已知在此温度下:
H+(aq)+OH-(aq)=H2O(I)△H=-aKJ/mol
HY(aq)⇌H+(aq)+Y-(aq)△H=+bKJ/mol
则HY和强碱稀溶液发生中和反应的热化学方程式为___.
(4)X的单质与某磁性氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为___
Ⅲ、若X为金属元素,Y为非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(5)含X的某盐与Y的气态氧化物都能做漂白剂,写出制备含X元素且具有漂白性的某盐的化学方程式___.
▼优质解答
答案和解析
Ⅰ.若X是短周期最活泼的金属元素,则X为Na元素,X的原子序数比Y大4,Y为N元素,
(1)根据图象可知,0.1000mol/L的HA溶液的pH=4,说明HA为弱酸,XOH为NaOH,
A.当HA与氢氧化钠恰好反应时,溶液中离子浓度增大,则溶液的导电性增强,故A、B、C三点所示溶液导电能力最强的是C点对应的溶液,故A正确;
B.在C点溶液中,HA与氢氧化钠恰好反应生成NaA,根据质子守恒可得:c(H+)+c(HA)=c(OH-),故B正确;
C.25℃,C点溶液的pH=8,则氢离子浓度为1.0×10-8mol/L,A-的浓度约为0.05mol/L,结合C点的质子守恒c(H+)+c(HA)=c(OH-)可得:c(HA)=c(OH-)-c(H+)≈1×10-6mol/L,所以HA的电离平衡常数约为Ka=
=5.0×10-4,故C正确;
故答案为:ABC;
(2)Y为N元素,一定条件下在体积不变的容器发生反应:2NO(g)+O2(g)⇌2NO2(g),
①该反应的平衡常数表达式K=
;已知K300℃>K350℃,说明升高温度,平衡向着逆向移动,则该反应为放热反应,
故答案为:
;放;
②a.v(NO2)=2v(O2),没有告诉正反应还是逆反应,无法判断是否达到平衡状态,故a错误;
b.该反应为气体体积缩小的反应,反应过程中气体的氧气逐渐减小,当容器内压强保持不变,则该反应的正逆反应速率相等,反应达到平衡状态,故b正确;
c.v逆(NO)=2v正(O2),表明正逆反应速率相等,达到了平衡状态,故c正确;
d.该反应的反应物和生成物都是气体,则气体的质量始终不变,又容器的容积不变,则容器内密度始终不变,所以密度不能作为判断平衡状态的标志,故d错误;
故答案为:bc;
③为使该反应的反应速率增大,且平衡向正反应方向移动,
a.及时分离处NO2气体,生成物浓度减小,则反应速率减小,故a错误;
b.该反应为放热反应,适当升高温度,平衡向着逆向移动,故b错误;
c.增大O2的浓度,反应物浓度增大,则反应速率增大,平衡向着正向移动,故c正确;
d.选择高效催化剂,反应速率增大,但是不影响化学平衡,故d错误;
故答案为:c;
Ⅱ.若X的离子半径是第三周期离子半径最小的,则X为Al元素,Y的原子序数为:13-4=9,为F元素,
(3)已知在此温度下:
①H+(aq)+OH-(aq)=H2O(I)△H=-aKJ/mol
②HF(aq)⇌H+(aq)+F-(aq)△H=+bKJ/mol
根据盖斯定律,①+②可得:则HY和强碱稀溶液发生中和反应的热化学方程式为:HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H=(b-a)kJ•mol-1,
故答案为:HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H=(b-a)kJ•mol-1;
(4)X的单质为Al,与某磁性氧化物在高温下反应生成氧化铝和铁,该反应的化学方程式为:3Fe3O4+8Al
9Fe+4Al2O3,
故答案为:3Fe3O4+8Al
9Fe+4Al2O3;
Ⅲ.若X为金属元素,Y为非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca元素,Y的原子序数为:20-4=16,为S元素,
(5)含X的某盐与Y的气态氧化物都能做漂白剂,制备含X元素且具有漂白性的某盐的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(1)根据图象可知,0.1000mol/L的HA溶液的pH=4,说明HA为弱酸,XOH为NaOH,
A.当HA与氢氧化钠恰好反应时,溶液中离子浓度增大,则溶液的导电性增强,故A、B、C三点所示溶液导电能力最强的是C点对应的溶液,故A正确;
B.在C点溶液中,HA与氢氧化钠恰好反应生成NaA,根据质子守恒可得:c(H+)+c(HA)=c(OH-),故B正确;
C.25℃,C点溶液的pH=8,则氢离子浓度为1.0×10-8mol/L,A-的浓度约为0.05mol/L,结合C点的质子守恒c(H+)+c(HA)=c(OH-)可得:c(HA)=c(OH-)-c(H+)≈1×10-6mol/L,所以HA的电离平衡常数约为Ka=
| 1×10-8×0.05 |
| 1×10-6 |
故答案为:ABC;
(2)Y为N元素,一定条件下在体积不变的容器发生反应:2NO(g)+O2(g)⇌2NO2(g),
①该反应的平衡常数表达式K=
| c2(NO2) |
| c2(NO)c(O2) |
故答案为:
| c2(NO2) |
| c2(NO)c(O2) |
②a.v(NO2)=2v(O2),没有告诉正反应还是逆反应,无法判断是否达到平衡状态,故a错误;
b.该反应为气体体积缩小的反应,反应过程中气体的氧气逐渐减小,当容器内压强保持不变,则该反应的正逆反应速率相等,反应达到平衡状态,故b正确;
c.v逆(NO)=2v正(O2),表明正逆反应速率相等,达到了平衡状态,故c正确;
d.该反应的反应物和生成物都是气体,则气体的质量始终不变,又容器的容积不变,则容器内密度始终不变,所以密度不能作为判断平衡状态的标志,故d错误;
故答案为:bc;
③为使该反应的反应速率增大,且平衡向正反应方向移动,
a.及时分离处NO2气体,生成物浓度减小,则反应速率减小,故a错误;
b.该反应为放热反应,适当升高温度,平衡向着逆向移动,故b错误;
c.增大O2的浓度,反应物浓度增大,则反应速率增大,平衡向着正向移动,故c正确;
d.选择高效催化剂,反应速率增大,但是不影响化学平衡,故d错误;
故答案为:c;
Ⅱ.若X的离子半径是第三周期离子半径最小的,则X为Al元素,Y的原子序数为:13-4=9,为F元素,
(3)已知在此温度下:
①H+(aq)+OH-(aq)=H2O(I)△H=-aKJ/mol
②HF(aq)⇌H+(aq)+F-(aq)△H=+bKJ/mol
根据盖斯定律,①+②可得:则HY和强碱稀溶液发生中和反应的热化学方程式为:HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H=(b-a)kJ•mol-1,
故答案为:HF(aq)+OH-(aq)=F-(aq)+H2O(l)△H=(b-a)kJ•mol-1;
(4)X的单质为Al,与某磁性氧化物在高温下反应生成氧化铝和铁,该反应的化学方程式为:3Fe3O4+8Al
| ||
故答案为:3Fe3O4+8Al
| ||
Ⅲ.若X为金属元素,Y为非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂,则X为Ca元素,Y的原子序数为:20-4=16,为S元素,
(5)含X的某盐与Y的气态氧化物都能做漂白剂,制备含X元素且具有漂白性的某盐的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
看了X、Y是元素周期表前20号元素...的网友还看了以下:
两种短周期元素X和Y,可以组成化合物XY3,当Y的原子序数为m时,X的原子序数为1.m-42.m+ 2020-04-08 …
在短周期中的X和Y两种元素可组成化合物XY3,说法正确的是()A.X和Y一定不属于同一主族B.X和 2020-04-08 …
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为 2020-04-08 …
X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物Z 2020-04-08 …
(2014•浙江模拟)X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素 2020-06-12 …
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX; 2020-07-22 …
短周期元素X、Y、M、N的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10. 2020-07-26 …
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为1 2020-11-01 …
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为1 2020-11-01 …
X、Y、Z、M、W为五种原子序数依次增大短周期元素。Y、Z、M是同一周期的元素,且最外层电子数之和为 2020-11-01 …