早教吧作业答案频道 -->化学-->
A、B、C、D为原子序数依次增大的四种元素,A2-和B2+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:(1)四种
题目详情
A、B、C、D为原子序数依次增大的四种元素,A2-和B2+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
(1)四种元素中电负性最大的是___(填元素符号),其中C原子的次外层电子排布式为___.
(2)单质A有两种同素异形体,其中沸点高的是___(填分子式),原因是___;B的氢化物所属的晶体类型是___,B单质所形成的晶体,一个晶胞平均含有___个原子.
(3)C和D反应可生成组成比为1:5的化合物E,E的分子式为___,已知该分子的空间构
型为三角双锥,则其中两个Cl原子被F原子所替代得到的产物结构有___种.
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为___,单质D与Na2SO3
溶液反应,其离子方程式为___.
(5)A和B能够形成化合物F,F晶体中的B2+离子的排列方式如下图所示,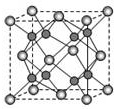
①每个B2+周围最近的等距离的B2+离子有个.
②已知F的晶胞参数是a0=0.54nm,它的密度为___(只列式不作计算,阿伏加德罗常数为6.02×1023mol-1).
(1)四种元素中电负性最大的是___(填元素符号),其中C原子的次外层电子排布式为___.
(2)单质A有两种同素异形体,其中沸点高的是___(填分子式),原因是___;B的氢化物所属的晶体类型是___,B单质所形成的晶体,一个晶胞平均含有___个原子.
(3)C和D反应可生成组成比为1:5的化合物E,E的分子式为___,已知该分子的空间构
型为三角双锥,则其中两个Cl原子被F原子所替代得到的产物结构有___种.
(4)化合物D2A的立体构型为___,中心原子的价层电子对数为___,单质D与Na2SO3
溶液反应,其离子方程式为___.
(5)A和B能够形成化合物F,F晶体中的B2+离子的排列方式如下图所示,

①每个B2+周围最近的等距离的B2+离子有个.
②已知F的晶胞参数是a0=0.54nm,它的密度为___(只列式不作计算,阿伏加德罗常数为6.02×1023mol-1).
▼优质解答
答案和解析
C核外电子总数是最外层电子数的3倍,应为P元素,C、D为同周期元素,则应为第三周期元素,D元素最外层有一个未成对电子,应为Cl元素,A2-和B2+具有相同的电子构型,结合原子序数关系可知A为O元素,B为Mg元素,
(1)四种元素分别为O、Na、P、Cl,电负性最大的为O元素,C为P元素,P原子的次外层电子排布式为2s22p6,
故答案为:O;2s22p6;
(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对分子质量较大,则范德华力较大,沸点较高,B的氢化物为MgH2,为离子晶体,B单质形成的晶体为镁晶体,为简单立方结构,根据均摊法可知,晶胞中原子数目为8×
+1=2,
故答案为:O3;O3相对分子质量较大,范德华力较大;离子晶体;2;
(3)C和D反应可生成组成比为1:5的化合物为PCl5,其空间构型为三角双锥,其中两个Cl原子被F原子所替代得到的产物中可以是双锥上的氯原子被替代,也可以是中间三角形上的两个氯原子被替代,也可以是一个锥上的氯和一个中间三角形上的氯被替代,所以得到的产物结构有3种,
故答案为:PCl5;3;
(4)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为
=2,则中心原子的价层电子对数为4,立体构型为V形,
氯气与湿润的Na2CO3反应可制备Cl2O,反应的方程式为Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
故答案为:V形;4;Cl2+SO32-+H2O=2Cl-+SO42-+2H+;
(5)A和B能够形成化合物F为氧化镁,是离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则镁的个数为8,O的个数为8×
+6×
=4,N(Mg):N(O)=1:1,每个Mg2+周围最近的等距离的Mg2+离子有12个,晶胞的质量为
,晶胞的体积为(0.54×10-7)cm3,
则晶体F的密度为
,
故答案为:12;
.
(1)四种元素分别为O、Na、P、Cl,电负性最大的为O元素,C为P元素,P原子的次外层电子排布式为2s22p6,
故答案为:O;2s22p6;
(2)A为O元素,有O2、O3两种同素异形体,二者对应的晶体都为分子晶体,因O3相对分子质量较大,则范德华力较大,沸点较高,B的氢化物为MgH2,为离子晶体,B单质形成的晶体为镁晶体,为简单立方结构,根据均摊法可知,晶胞中原子数目为8×
| 1 |
| 8 |
故答案为:O3;O3相对分子质量较大,范德华力较大;离子晶体;2;
(3)C和D反应可生成组成比为1:5的化合物为PCl5,其空间构型为三角双锥,其中两个Cl原子被F原子所替代得到的产物中可以是双锥上的氯原子被替代,也可以是中间三角形上的两个氯原子被替代,也可以是一个锥上的氯和一个中间三角形上的氯被替代,所以得到的产物结构有3种,
故答案为:PCl5;3;
(4)化合物D2A为Cl2O,O为中心原子,形成2个δ键,孤电子对数为
| 6-2×1 |
| 2 |
氯气与湿润的Na2CO3反应可制备Cl2O,反应的方程式为Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
故答案为:V形;4;Cl2+SO32-+H2O=2Cl-+SO42-+2H+;
(5)A和B能够形成化合物F为氧化镁,是离子化合物,阴离子位于晶胞的顶点和面心,阳离子位于晶胞的体心,则镁的个数为8,O的个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×40g/mol |
| 6.02×1023/mol |
则晶体F的密度为
| 4×40g/mol |
| (0.54×10-7cm)3×6.02×1023mol-1 |
故答案为:12;
| 4×40g/mol |
| (0.54×10-7cm)3×6.02×1023mol-1 |
看了A、B、C、D为原子序数依次增...的网友还看了以下:
如果实方阵a满足aat=ata=i 则称a为正交矩阵 设a b为同阶正交矩阵 证明:at是正交矩阵 2020-04-05 …
有机物A的碳骨架结构为,已知立方烷(C8H8)与互为同分异构体,请写出属于醛类、芳香化合物且与有机 2020-05-13 …
若A,B为同阶矩阵,且满足AB=0,则有()A.A=0或B=0B.|A|=0或|B|=0c(A+B 2020-06-24 …
设A,B为同阶方阵,且通过初等变换可以化成相同的标准形,则:A.A和B的秩相等.B.A与B合同设A 2020-06-30 …
(2014•日照一模)水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:已知请回答 2020-07-05 …
已知a为IIA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且A.b为同一周期元素,下列关系 2020-07-29 …
设A,B为同阶可逆方阵,则下列说法正确的是秩(A+B)=秩(A)+秩(B)(AB)^-1=B^-1A 2020-11-02 …
化合物(CH3)2=C(CH3)CH2CH2CH=CHCH3与过量酸性KMnO4反应得到下列物质(C 2020-11-02 …
已知芳香烃A、B的结构模型如下图所示,相关叙述正确的是()A.B.A.A的结构简式为,其一氯代物有2 2020-11-07 …
下列是一些微观粒子结构示意图,有关叙述正确的是()A.②⑤为同一周期元素的原子B.①②的元素在周期表 2020-12-12 …