早教吧作业答案频道 -->化学-->
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:(1)写出硅原子的电子排布式.C、Si、N的电负性由大到小的顺序是.(2)氟化氢水溶液中存在氢键有
题目详情
碳、氢、氟、氮、硅等非金属元素与人类的生产生活息息相关.回答下列问题:
(1)写出硅原子的电子排布式___.C、Si、N的电负性由大到小的顺序是___.
(2)氟化氢水溶液中存在氢键有___种.
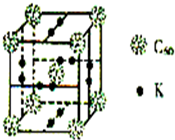
(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如右图所示,该物质中K原子和C60分子的个数比为___.
(4)继C60后,科学家又合成了Si60、N60.请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是:___.
(5)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等.铑(Rh)与钴属于同族元素,某些性质相似.现有铑的某盐组成为CsRh(SO4)2•4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成.请写出该盐溶解于水后的电离方程式:___.
(6)氧化镁的晶格能___氧化钙(填大于、小于),由岩浆晶出规则可推测___先从岩浆中析出.

(1)写出硅原子的电子排布式___.C、Si、N的电负性由大到小的顺序是___.
(2)氟化氢水溶液中存在氢键有___种.
(3)科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如右图所示,该物质中K原子和C60分子的个数比为___.
(4)继C60后,科学家又合成了Si60、N60.请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是:___.
(5)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+ 等.铑(Rh)与钴属于同族元素,某些性质相似.现有铑的某盐组成为CsRh(SO4)2•4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成.请写出该盐溶解于水后的电离方程式:___.
(6)氧化镁的晶格能___氧化钙(填大于、小于),由岩浆晶出规则可推测___先从岩浆中析出.
▼优质解答
答案和解析
(1)Si是14号元素,其原子核外有14个电子,根据能量最低原理知,其核外电子排布式为:1s22s22p63s23p1,同一周期中元素的电负性随着原子序数的增大而增大,同一主族中元素的电负性随着原子序数的增大而减小,C、N属于同一周期,C的原子序数小于N,所以C的电负性小于N,C和Si元素属于同一主族,C的原子序数小于Si元素,则C元素的电负性大于Si,所以电负性N>C>Si,
故答案为:1s22s22p63s23p1;N>C>Si;
(2)氟化氢的水溶液中存在的氢键有:氟化氢分子间、水分子间、水中氢原子和氟化氢中氟原子之间、氟化氢中氢原子和水中氧原子之间,所以一共有4种氢键,
故答案为:4;
(3)该晶胞中C60个数=1+8×
=2,6×2×
=6,所以K原子和C60分子的个数比为6:2=3:1,故答案为:3:1;
(4)Si60、N60、C60都是结构相似的分子晶体,分子晶体的熔点与其相对分子质量成正比,相对分子质量越大,分子间作用力越强,熔化所需能量越多,所以熔点Si60>N60>C60;破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多,所以破坏分子需要的能量顺序为:N60>C60>Si60,
故答案为:由于结构相似的分子晶体的相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点是Si60>N60>C60;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,(或成键电子数越多,成键原子半径越小)断键所需能量越多,故破坏分子需要的能量顺序为N60>C60>Si60;
(5)CsRh(SO4)2•4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,说明硫酸根为配体,铑(Rh)与钴属于同族元素,某些性质相似,由Co3+形成的配合物可知CsRh(SO4)2•4H2O中配体数目为6,溶于水电离为Cs+、[Rh(SO4)2(H2O)4]-,电离方程式为:CsRh(SO4)2•4H2O=Cs++[Rh(SO4)2(H2O)4]-,
故答案为:CsRh(SO4)2•4H2O=Cs++[Rh(SO4)2(H2O)4]-;
(6)氧化镁、氧化钙晶体中离子所带电荷相同,镁离子半径小于钙离子半径,离子半径越小晶格能越大,故晶格能:氧化镁>氧化钙,晶格能越大越容易在岩浆中析出,氧化镁更容易从岩浆中析出,
故答案为:大于;氧化镁.
故答案为:1s22s22p63s23p1;N>C>Si;
(2)氟化氢的水溶液中存在的氢键有:氟化氢分子间、水分子间、水中氢原子和氟化氢中氟原子之间、氟化氢中氢原子和水中氧原子之间,所以一共有4种氢键,
故答案为:4;
(3)该晶胞中C60个数=1+8×
| 1 |
| 8 |
| 1 |
| 2 |
(4)Si60、N60、C60都是结构相似的分子晶体,分子晶体的熔点与其相对分子质量成正比,相对分子质量越大,分子间作用力越强,熔化所需能量越多,所以熔点Si60>N60>C60;破坏分子需要断开化学键,元素的电负性越大,其形成的化学键越稳定,断键需要的能量越多,所以破坏分子需要的能量顺序为:N60>C60>Si60,
故答案为:由于结构相似的分子晶体的相对分子质量越大,分子间作用力(或范德华力)越强,熔化所需的能量越多,故熔点是Si60>N60>C60;而破坏分子需断开化学键,元素电负性越强其形成的化学键越稳定,(或成键电子数越多,成键原子半径越小)断键所需能量越多,故破坏分子需要的能量顺序为N60>C60>Si60;
(5)CsRh(SO4)2•4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,说明硫酸根为配体,铑(Rh)与钴属于同族元素,某些性质相似,由Co3+形成的配合物可知CsRh(SO4)2•4H2O中配体数目为6,溶于水电离为Cs+、[Rh(SO4)2(H2O)4]-,电离方程式为:CsRh(SO4)2•4H2O=Cs++[Rh(SO4)2(H2O)4]-,
故答案为:CsRh(SO4)2•4H2O=Cs++[Rh(SO4)2(H2O)4]-;
(6)氧化镁、氧化钙晶体中离子所带电荷相同,镁离子半径小于钙离子半径,离子半径越小晶格能越大,故晶格能:氧化镁>氧化钙,晶格能越大越容易在岩浆中析出,氧化镁更容易从岩浆中析出,
故答案为:大于;氧化镁.
看了碳、氢、氟、氮、硅等非金属元素...的网友还看了以下:
银是电阻率很小的导电体,假设银导线中50%的银原子的最外层电子脱离原子核的束缚而成为自由电子.①求 2020-05-13 …
(22-3)18初中物理,导体中一定有大量的什么?请说明选择理由.导体内一定有大量的[]A.自由电 2020-06-08 …
能量为Ei的光子照射基态氢原子,刚好可使该原子中的电子成为自由电子.这一能量Ei称为氢的电离能.现 2020-06-16 …
将氢原子电离,需要从外部给电子以能量,使其从基态或激发态脱离原子核束缚而成为自由电子.若要使n=2 2020-07-06 …
(1)能量为Ei的光子照射基态氢原子,刚好可使该原子中的电子成为自由电子.这一能Ei称为氢的电离能 2020-07-10 …
导体容易导电是因为导体中有大量能移动的自由电子. 2020-11-24 …
芯片是所有电脑.“智能家电”的核心部件,它是以高纯度的单质硅(硅的元素符号为Si)为材料制成的.用化 2020-12-19 …
如图所示,一段长方体金属导电材料,厚度为a、高度为b、长度为l,内有带电量为e的自由电子.该导电材料 2020-12-20 …
银是电阻率很小的导电体,假设银导线中50%的银原子的最外层电子脱离原子核的束缚而成为自由电子.求银导 2021-01-22 …
铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.Ⅰ、(1)Al元素的原子核外共有种同能级的电 2021-02-01 …