早教吧作业答案频道 -->化学-->
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.(1)
题目详情
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
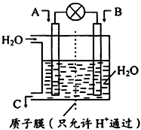
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2⇌CH3OH+H2O
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:___;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=___,该反应的△H___0(填“>”或“<”).
②实验3中,若平衡时,CO的转化率大于水蒸气,则
的值___(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V逆___V正(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是___.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等
D.容器中气体的平均相对分子质量不随时间而变化.

(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2⇌CH3OH+H2O
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ•mol-1;
H2O(g)=H2O(l)△H=-c kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ•mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:___;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)⇌CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则
| b |
| a |
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时V逆___V正(填“<”,“>”,“=”).
④判断该反应达到平衡的依据是___.
A.CO2减少的化学反应速率和CO减少的化学反应速率相等
B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等
D.容器中气体的平均相对分子质量不随时间而变化.
▼优质解答
答案和解析
(1)SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
(2)应用盖斯定律解题,△H=-△H1-△H2+
△H3+2△H4=-(
c+2d-a-b)kJ•mol-1,所以CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-(
c+2d-a-b)kJ•mol-1,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-(
c+2d-a-b)kJ•mol-1;
(3)①实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=
=0.17,
故答案为:0.17;<;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则
>1,故答案为:
>1;
③900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol时,浓度商Qc=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆,故答案为:>;
④A.CO2减少的化学反应速率和CO减少的化学反应速率相等,证明正逆反应速率相等,达到了平衡,故正确;
B.反应前后气体系数和相等,容器内气体压强始终保持不变,所以压强不变的状态不一定平衡,故错误;
C.CO、H2O、CO2、H2的浓度相等,可能平衡也可能不平衡,故错误;
D.容器中气体的平均相对分子质量等于质量和物质的量的比值,质量和物质的量都不变化,所以容器中气体的平均相对分子质量始终不随时间而变化,此时的状态不一定是平衡状态,故错误.
故选A.
(2)应用盖斯定律解题,△H=-△H1-△H2+
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
(3)①实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=
| 0.4×0.4 |
| 1.6×0.6 |
故答案为:0.17;<;
②在反应中当反应物的物质的量之比等于化学计量数之比时,各反应物的转化率相等,某一种反应物越多,其转化率越低,而另一种反应物的转化率则越高,所以要使CO的转化率大于水蒸气,则
| b |
| a |
| b |
| a |
③900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol时,浓度商Qc=1>0.17=K,所以此时平衡要逆向移动,故V正<V逆,故答案为:>;
④A.CO2减少的化学反应速率和CO减少的化学反应速率相等,证明正逆反应速率相等,达到了平衡,故正确;
B.反应前后气体系数和相等,容器内气体压强始终保持不变,所以压强不变的状态不一定平衡,故错误;
C.CO、H2O、CO2、H2的浓度相等,可能平衡也可能不平衡,故错误;
D.容器中气体的平均相对分子质量等于质量和物质的量的比值,质量和物质的量都不变化,所以容器中气体的平均相对分子质量始终不随时间而变化,此时的状态不一定是平衡状态,故错误.
故选A.
看了燃煤能排放大量的CO、CO2、...的网友还看了以下:
某硫酸厂废气中SO2的回收利用方案如图所示.下列说法错误的是()A.X可能含有2种盐B.Y可能含有 2020-05-13 …
“硫酸和硫化氢反应的产物是什么?怎么会是S+SO2+H2O?那么二氧化硫不和硫化氢反应吗?” 我认 2020-05-17 …
SO3中的硫元素是+6价,叫亚硫酸某,SO2中硫是+4价,为什么还叫硫酸某?为什么不换过来念?错了 2020-06-05 …
铅及其化合物工业生产及日常生活具有非常广泛的用途。(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式 2020-06-08 …
高中化合价归中规律像比如H2S+H2SO4(浓)==S↓+SO2↑+2H2OS的化合价分别为-20 2020-06-13 …
常温时,用某新型充电电池电解如右图所示的l00mL溶液,充电电池的总反应为4Li+2SOCl24L 2020-07-22 …
磺酰氯(SO2Cl2)是一种有机氯化剂和锂电池正极活性物质.工业上制各磺酰氯的反应为:S02(g) 2020-07-29 …
请问混合溶液中物质的量浓度怎么算?请举任意选项为例计算T.T已知:Na2S2O3+H2SO4=S↓+ 2020-11-24 …
元素归中反应同一元素的最高价化合物与最低价化合物之间反应,能举出几个例子?比如,SH2S+H2SO4 2020-11-28 …
下列叙述正确的是()A.SO2能使高锰酸钾溶液褪色,说明SO2有漂白性B.水玻璃中通CO2可得到胶状 2021-01-12 …