早教吧作业答案频道 -->化学-->
甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H>0(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得
题目详情
甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H>0
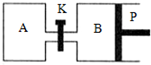
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___;列式并计算该反应的平衡常数K=___.
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)___.
①v正(CH3OH)=3v逆(H2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入
1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为___;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响).
CH3OH(g)+H2O(g)═CO2(g)+3H2(g);△H>0

(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___;列式并计算该反应的平衡常数K=___.
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)___.
①v正(CH3OH)=3v逆(H2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入
1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应.已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为___;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响).
▼优质解答
答案和解析
(1)依据化学平衡三段式列式计算,设反应的甲醇物质的量为x
CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)
起始量(mol) 1 3 0 0
变化量(mol) x x x 3x
20s量 (mol) 1-x 3-x x 3x
20s后,测得混合气体的压强是反应前的1.2倍,1-x+3-x+x+3x=4+2x=1.2×4,解得:x=0.4mol,
用甲醇表示该反应的速率为:v(CH3OH)=
=0.01mol/(L•s);
平衡时各组分的浓度为:c(CH3OH)=
=0.3mol/L、c(H2O)=
=1.3mol/L、c(CO2)=
=0.2mol/L、c(H2)=
=0.6mol/L,则该温度下该反应的平衡常数为:K=
≈1.1,
故答案为:0.01mol/(L•s);1.1;
(2)可逆反应达到平衡状态的依据是正逆反应速率相同,
①v正(CH3OH)=v正(CO2)是反应速率之比等于化学方程式计量数之比,不能说明该反应达到平衡,故①错误;
②反应前后气体质量不变,容器体积不变,反应过程中密度不变,混合气体的密度不变不能说明反应达到平衡,故②错误;
③反应前后气体物质的量增大,质量守恒,混合气体的平均相对分子质量不变,说明该反应已经达到平衡状态,故③正确;
④CH3OH、H2O、CO2、H2的浓度都不再发生变化,证明正逆反应速率相等,该反应达到平衡标志,故④正确;
故答案为:③④;
(3)①B容器的体积变为原来的1.5倍,增加的气体的物质的量为3.6 mol×0.5=1.8 mol,依据化学方程式可知增加2mol,反应甲醇1mol,则反应的甲醇的物质的量为0.9 mol,CH3OH的转化率=
×100%=75%,打开K时,AB组成一个等温等压容器,相应的起始投入总物质的量与平衡的总体积成正比,设打开K重新达到平衡后总的体积为x,则x:(3+3.6)=1.5a:3.6,解得:x=2.75a,所以B的体积为:2.75a-a=1.75a,
故答案为:75%;1.75a.
CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)
起始量(mol) 1 3 0 0
变化量(mol) x x x 3x
20s量 (mol) 1-x 3-x x 3x
20s后,测得混合气体的压强是反应前的1.2倍,1-x+3-x+x+3x=4+2x=1.2×4,解得:x=0.4mol,
用甲醇表示该反应的速率为:v(CH3OH)=
| ||
| 20s |
平衡时各组分的浓度为:c(CH3OH)=
| (1-0.4) |
| 2L |
| (3-0.4)mol |
| 2L |
| 0.4mol |
| 2L |
| 1.2mol |
| 2L |
| 0.63×0.2 |
| 0.3×1.3 |
故答案为:0.01mol/(L•s);1.1;
(2)可逆反应达到平衡状态的依据是正逆反应速率相同,
①v正(CH3OH)=v正(CO2)是反应速率之比等于化学方程式计量数之比,不能说明该反应达到平衡,故①错误;
②反应前后气体质量不变,容器体积不变,反应过程中密度不变,混合气体的密度不变不能说明反应达到平衡,故②错误;
③反应前后气体物质的量增大,质量守恒,混合气体的平均相对分子质量不变,说明该反应已经达到平衡状态,故③正确;
④CH3OH、H2O、CO2、H2的浓度都不再发生变化,证明正逆反应速率相等,该反应达到平衡标志,故④正确;
故答案为:③④;
(3)①B容器的体积变为原来的1.5倍,增加的气体的物质的量为3.6 mol×0.5=1.8 mol,依据化学方程式可知增加2mol,反应甲醇1mol,则反应的甲醇的物质的量为0.9 mol,CH3OH的转化率=
| 0.9mol |
| 1.2mol |
故答案为:75%;1.75a.
看了甲醇可以与水蒸气反应生成氢气,...的网友还看了以下:
椭圆的证明问题已知椭圆x^2 /16+y^2 /4=1上有2定点p,q,o为原点,连接op,oq若 2020-05-16 …
如图是抽水马桶水箱进水自动控制的结构原理图,AOB为一可绕固定点O转动的轻质杠杆,已知OA:OB= 2020-05-16 …
如图所示,质量不计的光滑木板AB长1.6m,可绕固定点O转动,离O点0.4m远的B端挂一重物G,板 2020-07-04 …
(2004年河北)如下图所示,质量不计的光滑木板AB长1.6m,可绕固定点O转动,离O点0.4m的 2020-07-04 …
求给以下算法复杂度排序增长速度由慢到快1)O(n^(3/4))O(log(n)^5)O(2^n)O 2020-07-23 …
如图所示,质量分别为2m和3m的两个小球镶嵌在一个质量不计的圆盘A、B两点.圆盘可绕固定转轴O在竖 2020-07-31 …
关于化学式的确定可以根据物质的量来确定物质的化学式么?例如某物质只含Fe与O,求得含Fe:0.03m 2020-11-03 …
如图甲是打开的汽车后备箱掀盖,图乙为简易测视示意图,AO′是可伸缩液压杆,其上端A点固定于后盖上,下 2020-11-10 …
下列说法错误的是()A.元素分析仪可以确定物质中是否含有C、H、O、N、Cl、Br等元素B.用红外光 2020-11-25 …
Thereaiesometomatoesintherefrigeratar(改为否定句)还有几个句子 2020-11-26 …