早教吧作业答案频道 -->化学-->
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如图1:已知:(ⅰ)PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0(ⅱ)Ksp(PbSO4)=1.08&t
题目详情
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如图1:
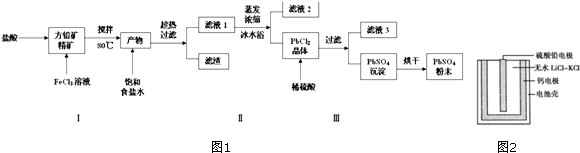
已知:(ⅰ)PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ反应过程中可以观察到淡黄色沉淀生成,请写出相应的离子方程式___,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是___.
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因___.
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式___.
(4)滤液2中加入H2O2可循环利用,请写出相关的离子方程式___.
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向___(填“负极”或“正极”)移动.
②负极反应式为___.
③电路中每转移0.2mol电子,理论上生成___g Pb.

已知:(ⅰ)PbCl2(s)+2Cl-(aq)⇌PbCl42-(aq)△H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ反应过程中可以观察到淡黄色沉淀生成,请写出相应的离子方程式___,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是___.
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因___.
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式___.
(4)滤液2中加入H2O2可循环利用,请写出相关的离子方程式___.
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向___(填“负极”或“正极”)移动.
②负极反应式为___.
③电路中每转移0.2mol电子,理论上生成___g Pb.
▼优质解答
答案和解析
(1)步骤Ⅰ中生成PbCl2和S,则加入的盐酸、氯化铁与PbS发生氧化还原反应,S元素化合价升高,则铁元素的化合价降低,反应的离子方程式为:PbS+2Fe3++2Cl-=PbCl2+2Fe2++S;Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液...
看了硫酸铅(PbSO4)广泛应用于...的网友还看了以下:
二阶实对称矩阵A的一个特征值为λ1=1,对应的特征向量为α1=(1,-1)T,|A|=-2.(1) 2020-05-14 …
1,“aq”表示什么?2,二氧化碳从固态变为气态,在这个过程中,等体反应热和等压反应热相等吗? 2020-05-17 …
立体几何[平行六面体和三棱锥]平行六面体的各棱长都等于4,在共顶点A的三条棱上分别取点P,Q,R, 2020-06-21 …
设实对称矩阵A=(1-20)(-22-2)(0-23),求正交矩阵Q,使Q-1,AQ为对角矩阵 2020-06-22 …
硫酸铅可用于铅蓄电池和制作颜料等.利用铅矿精矿(主要成分为PbS)直接制备硫酸铅粉末的流程如下:已 2020-07-08 …
若无穷数列{an}满足:只要ap=aq(p,q∈N*),必有ap+1=aq+1,则称{an}具有性 2020-07-09 …
等比数列的化简过程:aq^2+aq^3+aq^4=64(1/aq^2+1/aq^3+1/ap^4) 2020-07-17 …
数列an的每一项都为正数,a1=1/2,a2=4/5,且对满足m+n=p+q的正整数m,n,p,q 2020-07-22 …
如果n阶实对称矩阵A,B的特征多项式相同,则存在正交矩阵Q,使Q^(-1)AQ=B 2020-07-31 …
R为y正半轴的一个动点,过ABR三点做圆M,Q为圆M上一点,且RB=RQ,连接AR,AQ,当Q点运动 2020-11-04 …