(1)10min~20min以v(CO2)表示的反应速率为mol·L-1·s-1。(2)在10min和40min这两个时间分别改变了一个条件,则10min时改变的条件可能是(填选项字母)。A.升
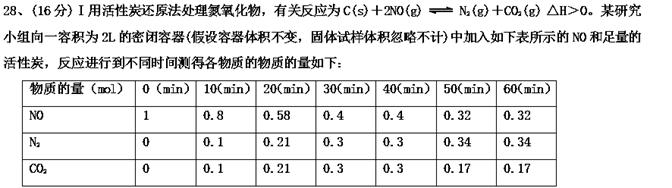 (1)10 min~20 min以 v (CO 2 )表示的反应速率为________ mol·L -1 ·s -1 。
(1)10 min~20 min以 v (CO 2 )表示的反应速率为________ mol·L -1 ·s -1 。
(2) 在10min和40min这两个时间分别改变了一个条件,则10min时改变的条件可能是________(填选项字母)。
A.升高温度 B.降低温度 C.加入催化剂
D.增加N 2 的浓度 E.减小NO的浓度 F.减小CO 2 的浓度
(3) 一定温度下,随着NO的起始浓度增大,则NO的平衡转化率________(填“增大”、“不变”或“减小”)。
Ⅱ臭氧是一种在生产生活中有着广泛运用的化学物质,可以用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。目前常用的人工制备臭氧的方法有:电晕放电法、电化学法、紫外线法等。其中电化学法因其设备简易,使用维修简单、安全,生成臭氧成分纯净等特点而得到广泛运用。某课外小组运用下图装置以PbO 2 做阳极,Pt电极为阴极电解饱和K 2 SO 4 溶液制备O 3 ,并采用碘量法测定臭氧的产率。(已知电解时在阳极可能有生成O 2 的副反应发生,碘量法测定的过程中不考虑O 2 和KI反应 )

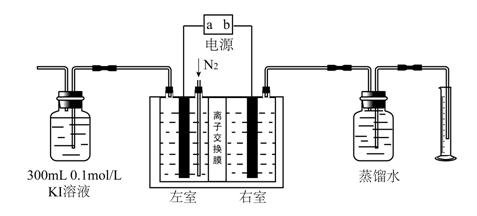
实验过程如下:
①按上图连接好装置,检查气密性后接通电源开始进行反应。
②电解的过程中以1.5L/min的速率鼓入N 2 ,使产生的O 3 能够完全被KI溶液吸收,反应后有O 2 生成(不考虑该过程中溶液体积变化)。
③电解20 min后,通过量筒测得右室中产生的气体体积为224 ml(已转化为标准状况)。
④将充分吸收了O 3 的300ml KI溶液取出30.00 ml,加入2滴0.1mol/L的淀粉溶液作指示剂,用0.01mol/L的Na 2 S 2 O 3 溶液进行滴定。测得消耗Na 2 S 2 O 3 溶液的体积为31.00ml。(已知反应的化学方程式为:I 2 + 2Na 2 S 2 O 3 = Na 2 S 4 O 6 + 2NaI )
(1)右室产生的气体为 (填化学式),写出左室发生的电极反应方程式 。
(2)写出KI溶液吸收O 3 的化学方程式 。
(3)该实验过程中鼓入N 2 的速率不能过快,若鼓入太快测定出臭氧的产率将偏 (填“大”或“小”),根据实验所得数据,该装置产生臭氧的产率为 。
设A为n阶矩阵,证明:R(A+I)+R(A-I)>=n已知R(A)=R(kA),k≠0;R(A+B 2020-05-14 …
选择填空 ()1.--- When are you going to kunming for ho 2020-05-17 …
i的i次方等于多少,写成x+yi的形式如题:i^i=?写成x+yi的形式,其中要求x和y都是实数. 2020-06-12 …
周末小华和妈妈一同去超市购物,当妈妈的购物车前轮遇到障碍物时,这时小华妈妈应该向(填选“上”或“下 2020-06-22 …
一直z=(2+i)(1+1/i){i为虚数单位}则复数Z在复平面上所对应的点位于几象限我算的是3+ 2020-07-03 …
P=A(1+i)^-1+A(1+i)^-2+A(i+i)^-3+……A(1+i)^-n(1)将两边 2020-07-25 …
选官制度是我国古代一项重要的政治制度。东晋南朝、隋唐、明清时期,选官制度不断发生变化。根据相关知识 2020-07-28 …
已知复数ω满足ω-4=(3-2ω)i(i为虚数单位),z=5/ω+|z-2|,若z的平方根为a=b 2020-08-02 …
一道挺难的数学题i*i=-1则x*x=-1可变为x=+i或-ii还具有以下性质:i=ii*i=-1i 2020-11-01 …
人民代表大会制度确立以来,我国的选举制度经历了三个阶段:阶段特点上世纪50年代乡镇人大代表实行直接选 2020-12-01 …