早教吧作业答案频道 -->化学-->
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.(1)用CH4催化还原氮氧化物可以消除
题目详情
2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160.0KJ•mol-1
③H2O(g)═H2O(l)△H=-44.0KJ•mol-1
则:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=___.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①下列说法不能作为判断该反应达到化学平衡状态标志的是___
A.活性炭的质量 B.v正(N2)=2v逆(NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
②在T0C时,该反应的平衡常数为___(小数点后保留两位有效数字);
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原
来的两倍,则化学平衡___(填“正向移动”、“逆向移动”或“不移动”)
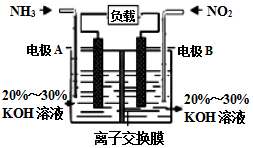
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.
①A电极的电极反应式为___
②下列关于该电池的说法正确的是___.
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol.

(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160.0KJ•mol-1
③H2O(g)═H2O(l)△H=-44.0KJ•mol-1
则:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=___.
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)⇌N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
物质 浓度(mol/L) 时间(min) | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.活性炭的质量 B.v正(N2)=2v逆(NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
②在T0C时,该反应的平衡常数为___(小数点后保留两位有效数字);
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原
来的两倍,则化学平衡___(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.
①A电极的电极反应式为___
②下列关于该电池的说法正确的是___.
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol.
▼优质解答
答案和解析
(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574.0kJ•mol-l
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160.0kJ•mol-l
③H2O(g)═H2O(l)△H=-44.0kJ•mol-l
依据盖斯定律计算[①+②+③×4]×
得到CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955.0 kJ•mol-1,
故答案为:-955.0 kJ•mol-1;
(2)①C(s)+2NO(g)⇌N2(g)+CO2(g),反应是气体体积不变的反应.
A.活性炭的质量保持不变说明达到平衡状态,故A不选;
B.反应速率之比等于化学方程式系数之比,当v正(N2)=2v逆(NO),不能说明反应达到平衡,当2v正(N2)=v逆(NO)则能说明达平衡,故B可选;
C.反应是气体体积不变的反应,反应过程中压强始终不变,所以容器内压强保持不变不能说明反应达到平衡,故C可选;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变时,说明反应达到平衡,故D不选;
E.混合气体的平均相对分子质量等于气体总质量除以总物质的量,反应中碳是固体,平衡移动,气体质量发生变化,气体物质的量不变,混合气体的平均相对分子质量保持不变时,说明反应达到平衡状态,故E不选;
故答案为:BC;
②20-30min反应达到平衡状态,C(s)+2NO(g)⇌N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.030mol/L;c(NO)=0.040mol/L,反应的平衡常数为:K=
=
=0.56,
故答案为:0.56;
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则此时Qc=
=
=0.28<K=0.56,则化学平衡正向移动,
故答案为:正向移动;
(3)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
②由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应.
A.电子从负极流出,正极流入,则电子从左侧电极经过负载后流向右侧电极,故A错误;
B.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,故B正确;
C.根据总反应可知反应生成水,电解质溶液的碱性减弱,pH减小,故C错误;
D.不是标准状况下无法计算NO2的物质的量及转移电子的物质的量,故D错误;
故答案为:B.
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2 O(g)△H=-1160.0kJ•mol-l
③H2O(g)═H2O(l)△H=-44.0kJ•mol-l
依据盖斯定律计算[①+②+③×4]×
| 1 |
| 2 |
故答案为:-955.0 kJ•mol-1;
(2)①C(s)+2NO(g)⇌N2(g)+CO2(g),反应是气体体积不变的反应.
A.活性炭的质量保持不变说明达到平衡状态,故A不选;
B.反应速率之比等于化学方程式系数之比,当v正(N2)=2v逆(NO),不能说明反应达到平衡,当2v正(N2)=v逆(NO)则能说明达平衡,故B可选;
C.反应是气体体积不变的反应,反应过程中压强始终不变,所以容器内压强保持不变不能说明反应达到平衡,故C可选;
D.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变时,说明反应达到平衡,故D不选;
E.混合气体的平均相对分子质量等于气体总质量除以总物质的量,反应中碳是固体,平衡移动,气体质量发生变化,气体物质的量不变,混合气体的平均相对分子质量保持不变时,说明反应达到平衡状态,故E不选;
故答案为:BC;
②20-30min反应达到平衡状态,C(s)+2NO(g)⇌N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.030mol/L;c(NO)=0.040mol/L,反应的平衡常数为:K=
| c(CO2)•c(N2) |
| c2(NO) |
| 0.030×0.030 |
| 0.0402 |
故答案为:0.56;
③在50min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则此时Qc=
| c(CO2)•c(N2) |
| c2(NO) |
| 0.034×2×0.017 |
| (0.032×2)2 |
故答案为:正向移动;
(3)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极电极方程式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
②由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应.
A.电子从负极流出,正极流入,则电子从左侧电极经过负载后流向右侧电极,故A错误;
B.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,故B正确;
C.根据总反应可知反应生成水,电解质溶液的碱性减弱,pH减小,故C错误;
D.不是标准状况下无法计算NO2的物质的量及转移电子的物质的量,故D错误;
故答案为:B.
看了2017年春节,京津冀及周边区...的网友还看了以下:
为确定A、B两种氮肥的组成为确定A、B两种氮肥的组成,进行下列实验:(1)分别取少量A、B氮肥试样与 2020-03-30 …
化学关于鉴定氮肥组成的题如题为确定AB氮肥的组成,进行如下实验1分别去少量AB氮肥试样与消石灰共热, 2020-03-30 …
用线段分别将氮气和稀有气体与他们的组成、用途、性质连接起来.①化学性质不活泼②无色无味气体a、氮气 2020-05-13 …
如何知道一个分子是由几个原子组成的,快,就像氧分子是由两个氧原子构成的,氮气是由氮分子组成,一个氮 2020-07-16 …
关于二氧化氮(NO2)的下列说法,正确的是()A.二氧化氮由二氧化氮分子组成B.二氧化氮由1个氮元 2020-07-20 …
镁条除可以在氧气中燃烧外,还可以在氮气中燃烧,生成由镁元素和氮元素组成的化合物.当镁元素与氮元素化 2020-07-28 …
为了确定A和B两种氮肥的组成,进行下列实验为了确定A、B两种氮肥混合物的组成,进行了下列实验:①分别 2020-11-03 …
提取RNA的昆虫还要用酒精先泡一下?组织取材后,在酒精里泡一下立即放入冻存管,快速放入液氮.实验时, 2020-11-13 …
1.一项工作,甲组3人8天能完成,乙组4人7天也能完成.现在由甲组2人和乙组7人合作,几天可以完成这 2020-11-27 …
近日,北京频频发牛雾霾天气(如图),雾霾主要由一氧化硫、氮氧化物和可吸入颗粒物这三项组成,前两者为气 2020-11-27 …