早教吧作业答案频道 -->化学-->
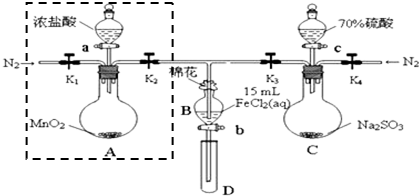
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略).实验过程:①检查装置气密性后,在各仪器中添加相应试剂.②打开弹簧夹K1~K4,通入一段
题目详情
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略).实验过程:
①检查装置气密性后,在各仪器中添加相应试剂.
②打开弹簧夹K1~K4,通入一段时间N2,将T型管插入B中,继续通入N2,然后关闭K1、K3、K4.
③打开活塞a,滴加一定量的浓盐酸,加热A.
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
⑦更换试管D,重复过程⑤,检验B溶液中的离子.
试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是___.
(2)C中发生反应的化学方程式为___.
(3)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为___.
(4)B中的棉花通常会浸润___试剂;实验②中通入N2的作用是___.
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性 Cl2>Fe3+>SO2的是___(填“甲”、“乙”或“丙”).
(6)进行实验过程⑥时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+SO32-(aq)⇌FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.某同学设计如下实验,证实该假设成立:
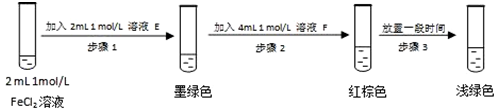
①溶液E和F分别为___、___.
②请结合方程式和化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因___.
①检查装置气密性后,在各仪器中添加相应试剂.
②打开弹簧夹K1~K4,通入一段时间N2,将T型管插入B中,继续通入N2,然后关闭K1、K3、K4.
③打开活塞a,滴加一定量的浓盐酸,加热A.
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
⑦更换试管D,重复过程⑤,检验B溶液中的离子.

试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是___.
(2)C中发生反应的化学方程式为___.
(3)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为___.
(4)B中的棉花通常会浸润___试剂;实验②中通入N2的作用是___.
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性 Cl2>Fe3+>SO2的是___(填“甲”、“乙”或“丙”).
| 过程⑤B溶液中含有的离子 | 过程⑦B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+SO32-(aq)⇌FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.某同学设计如下实验,证实该假设成立:

①溶液E和F分别为___、___.
②请结合方程式和化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因___.
▼优质解答
答案和解析
(1)根据大气压强原理来检验装置的气密性:关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加入水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好.
故答案为:关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加入水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好;
(2)亚硫酸钠可以和较浓的硫酸之间反应生成硫酸钠和水以及二氧化硫,即Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)二氧化硫具有还原性,高锰酸钾具有氧化性,SO2通入酸性高锰酸钾溶液,二者之间可以发生氧化还原反应:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+,故答案为:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+;
(4)装置A是制备氯气的,二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,氯气有毒,要用氢氧化钠进行吸收,由于装置中含有空气,而空气的存在,会对实验产生干扰,所以通入氮气的目的是排除装置中的空气,防止FeCl2溶液被O2氧化,
故答案为:NaOH溶液;排除装置中的空气,防止FeCl2溶液被O2氧化;
(5)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;故答案为:乙、丙;
(6)①实验中溶液显墨绿色,说明平衡向正反应方向移动,所以加入的应该是Na2SO3(或可溶性亚硫酸盐);而步骤2中溶液显红棕色,说明加入的应该是FeCl3 ,
故答案为:Na2SO3(或可溶性亚硫酸盐);FeCl3;
②由于Fe3+消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq)⇌FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色,
故答案为:Fe3+消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq)⇌FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色.
故答案为:关闭K1、K2,打开分液漏斗的盖子和活塞,向其中加入水,一段时间后分液漏斗尖嘴处不再滴液即证明气密性良好;
(2)亚硫酸钠可以和较浓的硫酸之间反应生成硫酸钠和水以及二氧化硫,即Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(3)二氧化硫具有还原性,高锰酸钾具有氧化性,SO2通入酸性高锰酸钾溶液,二者之间可以发生氧化还原反应:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+,故答案为:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+;
(4)装置A是制备氯气的,二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,氯气有毒,要用氢氧化钠进行吸收,由于装置中含有空气,而空气的存在,会对实验产生干扰,所以通入氮气的目的是排除装置中的空气,防止FeCl2溶液被O2氧化,
故答案为:NaOH溶液;排除装置中的空气,防止FeCl2溶液被O2氧化;
(5)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;故答案为:乙、丙;
(6)①实验中溶液显墨绿色,说明平衡向正反应方向移动,所以加入的应该是Na2SO3(或可溶性亚硫酸盐);而步骤2中溶液显红棕色,说明加入的应该是FeCl3 ,
故答案为:Na2SO3(或可溶性亚硫酸盐);FeCl3;
②由于Fe3+消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq)⇌FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色,
故答案为:Fe3+消耗 SO32-,c(SO32-)减小,使平衡Fe2+(aq)+SO32-(aq)⇌FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色.
看了为验证氧化性Cl2>Fe3+>...的网友还看了以下:
对于SO2和SO3中(1)相同质量的SO2和SO3中硫元素的质量比是.(2)SO2和SO3中所含氧 2020-06-22 …
Ⅰ以下是有关SO2、Cl2的性质实验.(1)某小组设计如图所示的装置图(图中夹持和加热装置略去), 2020-06-26 …
某亚硝酸钠生产厂采用硝酸为原料,其生产原理是NO+NO2+2NaOH═2NaNO2+H2O.工艺流 2020-06-29 …
我的问题是:请问,世界上的所有语言中的格数按照从大到小排列,最后的结果是怎样的?我举个例子:(1) 2020-07-08 …
以下是有关SO2、Cl2的性质实验.(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去), 2020-07-11 …
以下是有关SO2、CL2的性质实验.(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分 2020-12-19 …
Cl2和SO2是中学化学中常见的气体.(1)某活动小组设计如图所示的装置图(图中夹持和加热装置略去) 2020-12-19 …
以下是有关SO2、Cl2的性质实验。(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别 2020-12-19 …
以下是有关SO2、Cl2的性质实验.(1)某小组设计如图1所示的装置图(图中夹持和加热装置略去),分 2020-12-19 …
以下是有关SO2、Cl2的性质实验.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S 2020-12-19 …