早教吧作业答案频道 -->化学-->
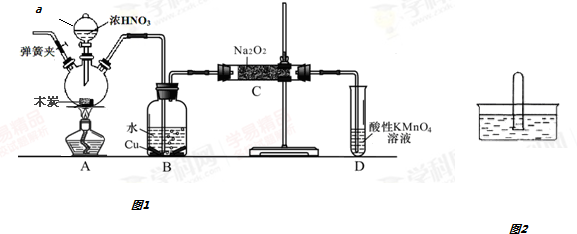
亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略).已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO
题目详情
亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示(部分夹持装置略).已知:
①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO与NO3-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称___.
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为___.
(3)写出NO与Na2O2在常温下生成NaNO2室温化学反应方程式___;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为___L.
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭___g.
(5)NO2易溶于水.将体积为V mL的试管充满NO2后倒扣在水中,见图2.
①NO2溶于水的化学方程式是___.
②使试管中NO2完全被水吸收的操作是___.

①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO与NO3-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称___.
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为___.
(3)写出NO与Na2O2在常温下生成NaNO2室温化学反应方程式___;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为___L.
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭___g.
(5)NO2易溶于水.将体积为V mL的试管充满NO2后倒扣在水中,见图2.
①NO2溶于水的化学方程式是___.
②使试管中NO2完全被水吸收的操作是___.
▼优质解答
答案和解析
(1)根据装置图可知a仪器的名称为分液漏斗,故答案为:分液漏斗;
(2)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置装碱石灰(或氢氧化钠固体或氧化钙固体),用来吸收二氧化碳和水蒸气,
故答案为:碱石灰(或氢氧化钠固体或氧化钙固体);
(3)根据电子得失守恒及元素守恒可写出NO与Na2O2在常温下生成NaNO2的方程式为2NO+Na2O2=2NaNO2,该反应中电子转移数目为1e-,根据方程式可知,当反应中转移0.1mole-时,吸收NO的物质的量为0.1mol,则NO的体积为2.24L,
故答案为:2NO+Na2O2=2NaNO2;2.24;
(4)根据①C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO,有关系式C~4NO2~
NO~
HNO3,根据③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
有关系式HNO3~
Cu~
NO,则有C~
NO,所以碳与总的NO的关系式为C~(
+
)NO,根据④2NO+Na2O2═2NaNO2,可知碳与Na2O2的关系式为C~Na2O2,所以11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要碳的质量为
×12g=1.8g,
故答案为:1.8.
(5)①NO2与水反应生成一氧化氮和硝酸,反应方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
②由于一氧化氮和氧气反应生成二氧化氮,结合①中的反应可得反应4NO2+H2O+O2═4HNO3,所以要使此试管中NO2完全被水吸收可向试管中缓缓通入V/4 mL氧气,
故答案为:缓缓通入V/4 mL氧气.
(2)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置装碱石灰(或氢氧化钠固体或氧化钙固体),用来吸收二氧化碳和水蒸气,
故答案为:碱石灰(或氢氧化钠固体或氧化钙固体);
(3)根据电子得失守恒及元素守恒可写出NO与Na2O2在常温下生成NaNO2的方程式为2NO+Na2O2=2NaNO2,该反应中电子转移数目为1e-,根据方程式可知,当反应中转移0.1mole-时,吸收NO的物质的量为0.1mol,则NO的体积为2.24L,
故答案为:2NO+Na2O2=2NaNO2;2.24;
(4)根据①C+4HNO3(浓)
| ||
| 4 |
| 3 |
| 8 |
| 3 |
有关系式HNO3~
| 3 |
| 8 |
| 1 |
| 2 |
| 2 |
| 3 |
| 4 |
| 3 |
| 2 |
| 3 |
| 11.7 |
| 78 |
故答案为:1.8.
(5)①NO2与水反应生成一氧化氮和硝酸,反应方程式为3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
②由于一氧化氮和氧气反应生成二氧化氮,结合①中的反应可得反应4NO2+H2O+O2═4HNO3,所以要使此试管中NO2完全被水吸收可向试管中缓缓通入V/4 mL氧气,
故答案为:缓缓通入V/4 mL氧气.
看了亚硝酸钠在漂白、电镀等方面应用...的网友还看了以下:
硫酸氢钠与硫酸它俩酸性差不多?纸都被硫酸氢钠炭化了,用硫酸氢钠泼人腐蚀性如何?硫酸氢钠怎么可以和金属 2020-03-31 …
帮忙造句用妮、役、硝、炭、谊、摇、噩、耗、跺、嫂、挎、篮造句子事成后给20分 2020-04-12 …
我有高猛酸钾,二氧化猛,镁条,氢氧化钙,氢氧化钠,炭酸钙,红磷,汾汰,和各种实验用具,请问我能做哪 2020-04-12 …
支气管造影常用造影剂为:( )A.硫酸钡B.泛影葡胺C.碘化油D.阿米培克E.泛影钠 2020-06-07 …
“春泛盐,秋泛硝.”有些地区的盐碱地里春天会析出食盐,到了秋天,又会析出芒硝(主要成分是Na2SO 2020-06-17 …
春泛盐,秋泛硝,有些地区的盐碱地里春天会析出食盐,秋天又会析出芒硝.同学们对‘硝’的成分产生了争议 2020-06-17 …
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化 2020-11-22 …
氧化镁在医药、建筑等行业应用广泛,木炭还原硫酸镁煅烧制备高纯氧化镁是一种新的探索.煅烧过程存在以下反 2020-12-14 …
亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚 2020-12-19 …
碳及其化合物在生活中应用广泛:①木炭具有吸附性;②一氧化碳用作气体燃料;③一氧化碳可用于炼铁;④干冰 2021-02-19 …