早教吧作业答案频道 -->化学-->
I.现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略).点燃酒精灯一段时间后,A
题目详情
I.现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略).
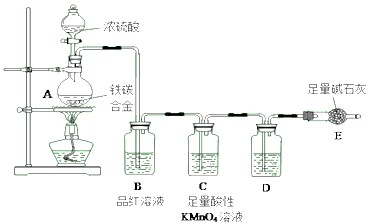
点燃酒精灯一段时间后,A、B中可观察到明显的现象:
(1)写出A中发生反应的化学方程式___(写浓硫酸只做氧化剂的).
(2)B中的现象是___,由此可得到浓硫酸具有___性;C中足量的酸性KMnO4溶液所起的作用是___.
(3)D中盛放的试剂是___.
II.某课外活动小组的同学,在实验室研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题.
(1)这样制取的二氧化硫气体中可能含有的杂质是___.
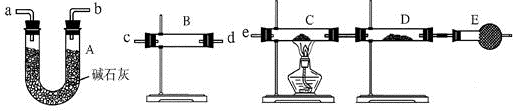
(2)某同学用下列装置连接成一整套实验装置以验证(1)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是___(用a、b…填写).
III.某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
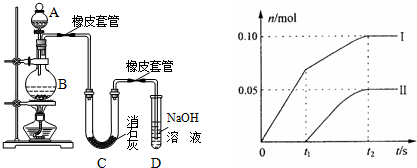
(1)A仪器的名称是___,D的作用___.
(2)漂白粉将在U型管中产生,其化学反应方程式是___.
(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是___,有同学测出了反应后溶液中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为曲线图(不考虑氯气和水的反应).
a、图中曲线I表示___离子的物质的量随反应时间变化的关系.
b、所取石灰乳中含有Ca(OH)2的物质的量为___mol.
c、另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=___
②试判断另一个副反应是(写出此反应方程式)___,为避免此副反应发生,可采取的措施是___.

点燃酒精灯一段时间后,A、B中可观察到明显的现象:
(1)写出A中发生反应的化学方程式___(写浓硫酸只做氧化剂的).
(2)B中的现象是___,由此可得到浓硫酸具有___性;C中足量的酸性KMnO4溶液所起的作用是___.
(3)D中盛放的试剂是___.
II.某课外活动小组的同学,在实验室研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题.
(1)这样制取的二氧化硫气体中可能含有的杂质是___.
(2)某同学用下列装置连接成一整套实验装置以验证(1)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是___(用a、b…填写).

III.某学生设计如下实验装置利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是___,D的作用___.
(2)漂白粉将在U型管中产生,其化学反应方程式是___.
(3)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是___,有同学测出了反应后溶液中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为曲线图(不考虑氯气和水的反应).
a、图中曲线I表示___离子的物质的量随反应时间变化的关系.
b、所取石灰乳中含有Ca(OH)2的物质的量为___mol.
c、另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=___
②试判断另一个副反应是(写出此反应方程式)___,为避免此副反应发生,可采取的措施是___.
▼优质解答
答案和解析
由装置图可知,该实验原理:通过测定干燥管E的质量增重确定二氧化碳的质量,根据二氧化碳的质量计算铁碳合金中碳的质量,进而计算铁的质量,再计算合金中铁的质量分数.故二氧化硫会影响二氧化碳的测定,进入干燥管E的气体应除去二氧化硫、且干燥.
(1)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,浓硫酸只做氧化剂,与铁加热反应浓硫酸做酸和氧化剂,所以反应方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(2)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使装置B中品红溶液褪色,说明反应中浓硫酸做氧化剂被还原为二氧化硫气体,证明具有强氧化性;C装置足量的酸性KMnO4溶液所起的作用是为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液逐渐褪色;强氧化性;除尽反应产物中的SO2气体;
(3)进入干燥管前的二氧化碳需要干燥,所以D装置中是浓硫酸干燥剂,D中盛放的试剂是浓硫酸;
故答案为:浓硫酸;
II.(1)浓硫酸具有强氧化性,Zn与浓硫酸反应生成硫酸锌、二氧化硫、水,
反应方程式为:Zn+2H2SO4 (浓)
ZnSO4+SO2↑+2H2O,随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g),
故答案为:氢气和水蒸气;
(2)先检验水的存在,将水除尽,再检验H2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H2,所以气流方向为:c d(或d c)a b(或b a)e,故答案为:c d(或d c)a b(或b a)e;
III.(1)装置中添加浓盐酸通过分液漏斗;氯气有毒,不能排放到空气中,氢氧化钠溶液的作用是吸收过量的氯气;故答案为:分液漏斗;吸收尾气;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却;
a、当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
b、根据氧化还原反应中得失电子数相等计算氯离子的物质的量,设氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯元素的物质的量=0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol;
c、取一份与②等物质的量的石灰乳,物质的量为0.25mol,根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO-)=x,n(ClO3-)=y;则得到:①0.37=x×1+y×5;依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,得到氯元素物质的量为0.5mol;②x+y+0.37=0.5;①②联立得到:
x=0.07mol,y=0.06mol;则n(ClO-)/n(ClO3-)=7:6;
故答案为:将U型管置于冷水浴中;ClO-;0.25;7:6
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O;需要在发生装置和U型管之间放饱和氯化钠溶液,吸收氯气中的氯化氢气体;
故答案为:2HCl+Ca(OH)2=CaCl2+2H2O;发生装置和U型管之间放饱和氯化钠溶液.
(1)碳与浓硫酸在加热的条件下生成二氧化硫、二氧化碳、水,浓硫酸只做氧化剂,与铁加热反应浓硫酸做酸和氧化剂,所以反应方程式为C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
(2)A中生成的气体含有CO2、2SO2,SO2具有漂白性,能使装置B中品红溶液褪色,说明反应中浓硫酸做氧化剂被还原为二氧化硫气体,证明具有强氧化性;C装置足量的酸性KMnO4溶液所起的作用是为除尽反应产物中的SO2气体,防止影响二氧化碳的质量测定,
故答案为:品红溶液逐渐褪色;强氧化性;除尽反应产物中的SO2气体;
(3)进入干燥管前的二氧化碳需要干燥,所以D装置中是浓硫酸干燥剂,D中盛放的试剂是浓硫酸;
故答案为:浓硫酸;
II.(1)浓硫酸具有强氧化性,Zn与浓硫酸反应生成硫酸锌、二氧化硫、水,
反应方程式为:Zn+2H2SO4 (浓)
| ||
故答案为:氢气和水蒸气;
(2)先检验水的存在,将水除尽,再检验H2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H2,所以气流方向为:c d(或d c)a b(或b a)e,故答案为:c d(或d c)a b(或b a)e;
III.(1)装置中添加浓盐酸通过分液漏斗;氯气有毒,不能排放到空气中,氢氧化钠溶液的作用是吸收过量的氯气;故答案为:分液漏斗;吸收尾气;
(2)漂白粉将在U形管中产生,是氯气和氢氧化钙反应生成氯化钙、次氯酸钙、水;其化学方程式为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
故答案为:2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却;
a、当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
b、根据氧化还原反应中得失电子数相等计算氯离子的物质的量,设氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯元素的物质的量=0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol;
c、取一份与②等物质的量的石灰乳,物质的量为0.25mol,根据氧化还原反应中得失电子数相等,生成氯离子得到电子和生成次氯酸根和氯酸根失去的电子守恒,设n(ClO-)=x,n(ClO3-)=y;则得到:①0.37=x×1+y×5;依据氯化钙、次氯酸钙、氯酸钙中钙离子和含氯元素的物质的量比为1:2,得到氯元素物质的量为0.5mol;②x+y+0.37=0.5;①②联立得到:
x=0.07mol,y=0.06mol;则n(ClO-)/n(ClO3-)=7:6;
故答案为:将U型管置于冷水浴中;ClO-;0.25;7:6
②装置中无氯气的除杂装置,挥发出的氯化氢会和氢氧化钙反应,反应的化学方程式为:2HCl+Ca(OH)2=CaCl2+2H2O;需要在发生装置和U型管之间放饱和氯化钠溶液,吸收氯气中的氯化氢气体;
故答案为:2HCl+Ca(OH)2=CaCl2+2H2O;发生装置和U型管之间放饱和氯化钠溶液.
看了I.现有某铁碳合金,某化学兴趣...的网友还看了以下:
物态变化应用题1.在标准大气压下从空气中提取氧气,氮气和二氧化碳气体,可采用什么方法?首先被分离出 2020-05-13 …
给你一盒火柴和一盏酒精灯,请你设计实验证明酒精灯火焰温度的高低.如果要证明焰心处的主要物质不是酒精 2020-05-14 …
给你一盒火柴和一盏酒精灯,请你设计实验证明酒精灯火焰温度的高低.如果要证明焰心处的主要物质不是酒精 2020-05-14 …
碳元素是组成许多物质的基本元素.(1)请画出碳原子的结构示意图.(2)实验室用的燃料是酒精,酒精完 2020-05-14 …
现有以下实验仪器和药品,酒精灯(内盛酒精),干洁的小烧杯,澄清石灰水、火柴,请你设计一个简单的实验 2020-05-14 …
碳14是一种质子数为6相对原子质量为14的原子,它可以蜕变为碳12.考古学中常用碳14蜕变的量来精 2020-07-05 …
计算碳—141.在一个山洞中发现一个木制工具,它含有碳—14的量是一棵活树的1/4,计算该工具年龄 2020-07-18 …
在制作食品时常加入味精调味(每500g春卷常加入422.5mg味精).味精是一种有机化合物--谷氨 2020-07-18 …
I.现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图 2020-12-19 …
下列部件中,装在话筒里的有,装在听筒里的有.A.永磁体B.螺线管C.碳粒D.用碳精制成的振动膜E.碳 2020-12-22 …