某化学兴趣小组进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。经过小组讨论,他们设计了如下装置进行实验(夹持装置未画出):烧瓶A中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制取N2
某化学兴趣小组进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。
经过小组讨论,他们设计了如下装置进行实验(夹持装置未画出):烧瓶A中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制取N2),干燥管B、G中均装有碱石灰,试管D、F、I中盛有澄清石灰水。
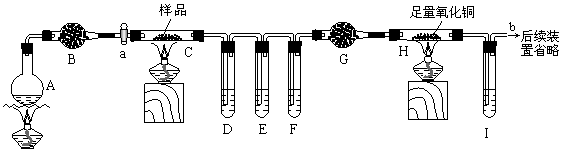
(1)连接好装置后,加入药品前应该进行的实验操作是_____________(填操作名称)。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________。
(3)试管E中的试剂为:________________。
(4)装置F的作用:______ ___。
Ⅰ.定性研究
(5)试管D中出现浑浊,证明产物中有____________存在;证明分解产物中存在CO的现象是_________________;要证明分解时产生的另一种气态产物的存在应该如何改进装置_____________;装置C反应后的固体残余物(经测无Fe),在煮沸的稀硫酸中完全溶解,取反应液加入KSCN溶液无血红色,证明固体产物为____________。
Ⅱ.定量分析(假定每一步反应进行完全)
(6)取7.2 g样品进行上述实验,测得硬质玻璃管C中残余固体2.88 g,硬质玻璃管H中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的化学方程式为__________________。
【答案】(1)检验装置气密性
(2)用生成的N2排除装置内的空气,避免空气中CO2对实验造成的干扰
(3)氢氧化钠(其它合理答案也得分
(4)检验二氧化碳是否被吸收完全,防止影响H实验产物的检验。
(5)CO2 F中不出现浑浊,I中出现浑浊(H内固体变红) 在CD之间连一个盛有无水CuSO4的装置 FeO
(6)FeC2O4·2H2O![]() FeO+CO↑+CO2↑+2H2O
FeO+CO↑+CO2↑+2H2O
【解析】
试题分析:(1)由图分析可知,装置A是生成氮气的发生装置,利用生成氮气提供惰性环境,避免干扰分解产物的分析和验证,加入药品前,应该进行的实验操作是检查装置气密性;
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是利用氮气排除装置中的空气,避免空气中CO2对实验造成干扰;
(3)试管E中的试剂是用来吸收产生的二氧化碳的,可以用氢氧化钠溶液;
(4)装置F的作用检验二氧化碳是否被吸收完全,防止影响H实验产物的检验;
(5)D中是澄清石灰水,生成沉淀证明生成二氧化碳,证明一氧化碳生成可以利用装置F中澄清石灰水不变浑浊,一氧化碳还原氧化铜反应生成二氧化碳通过I澄清石灰水变浑浊;结晶水合物分解生成水蒸气,在CD间加一个成无水硫酸铜的干燥管证明水的生成,将充分反应后的固体残余物投入经煮沸的稀硫酸中溶解,取反应液加入KSCN溶液无血红色,证明无铁离子存在,分解生成的固体产物应为FeO;
(6)上述实验分析,测得硬质玻璃管C中残余固体2.88g,为氧化亚铁的质量,计算得到铁元素物质的量=2.88/72=0.04mol,硬质玻璃管H中固体质量减轻0.64g是一氧化碳还原氧化铜反应前后质量变化,结合化学方程式计算反应的一氧化碳物质的量,
CuO+CO=Cu+CO2,△m
1mol 16g
0.04 0.64g
结合元素守恒铁元素物质的量为0.04mol,7.2g样品物质的量为0.04mol,摩尔质量=7.2/0.04=180g/mol,依据FeC2O4•nH2O计算得到n=2,生成一氧化碳物质的量为0.04mol,氧化亚铁物质的量为0.04mol,水的物质的量为0.08mol,结合氧化还原反应电子守恒计算得到二氧化碳物质的量为0.04mol,反应的化学方程式为:
FeC2O4•2H2O![]() FeO+CO↑+CO2↑+2H2O
FeO+CO↑+CO2↑+2H2O
考点:性质实验方案的设计
若关于x 的方程9^x+(4+a)3^x+4=0有解,则实数a的取值范围?若关于x 的方程9^x+ 2020-04-05 …
已知在pH为4-5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生欲用电解纯净的CuS 2020-05-13 …
爱解决数学题的,爱得悬赏值的请过来解救我的数学题.1.已知实心求的体积256立方厘米,将它融化成4 2020-05-17 …
马克思主义哲学是:(单选题)A:从物质第一性,精神第二性出发解决哲学基本问题的B从理论和实践的关系 2020-06-16 …
若关于x的不等式2x2-8x-4-a>0在1<x<4内有解,则实数a的取值范围是()若关于x的不等 2020-07-31 …
当m为何值时方程x?-4|x|+5=m,1.无解.2,有两个实数解3.,有三个实数解4, 2020-07-31 …
高一化学题目,求解4.科学的实验方法为我们探索物质的世界提供了一把金钥匙.下列实验错误的是()A.用 2020-11-01 …
六年级的数学题,急急急,另加分!!!1、求下面各比的比值。24:3621/9:7/127.5:41/ 2020-11-15 …
4,实验小学科学课外兴趣班有男生22人,女生14人.(1)如果把科学课外兴趣班平均分成9个小组,4, 2020-11-28 …
我们现在学了光和物态变化,老师要求做一个实验装置,要求:必须有最后的实物样品选材:1)家庭趣味实验装 2021-01-01 …