早教吧作业答案频道 -->化学-->
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1(1)生产中为提高反应速率和SO2的转化率,下列措施
题目详情
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
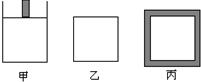
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是___.
A.向装置中充入O2 B.升高温度C.向装置中充入N2 D.向装置中充入过量的SO2
(2)500℃时,将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,反应中数据如表所示:
①反应前4分钟的平均速率v(O2)=___.
②500℃时该反应的平衡常数K=___.(保留1位小数.)
(3)恒温恒压,通入3mol SO2和2mol O2及固体催化剂,平衡时容器内气体体积为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),下列说法正确的是___.
A.第一次平衡时反应放出的热量为294.9kJ B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等 D.第二次平衡时SO3的体积分数等于
(4)如果在500℃时向下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.
①平衡常数:K (甲)___K(丙) (填“>”、“<”或“=”下同),达到平衡时SO2的转化率:α(乙)___α(丙).
②达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体,甲容器的化学平衡___移动,乙容器的化学平衡___移动.(填“正向”、“逆向”或“不”)

(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是___.
A.向装置中充入O2 B.升高温度C.向装置中充入N2 D.向装置中充入过量的SO2
(2)500℃时,将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,反应中数据如表所示:
| 时间/(min) | 2 | 4 | 6 | 8 |
| n(SO3)/(mol) | 4.2 | 8.0 | 9.4 | 9.4 |
②500℃时该反应的平衡常数K=___.(保留1位小数.)
(3)恒温恒压,通入3mol SO2和2mol O2及固体催化剂,平衡时容器内气体体积为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),下列说法正确的是___.
A.第一次平衡时反应放出的热量为294.9kJ B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等 D.第二次平衡时SO3的体积分数等于
| 2 |
| 9 |
(4)如果在500℃时向下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡.
①平衡常数:K (甲)___K(丙) (填“>”、“<”或“=”下同),达到平衡时SO2的转化率:α(乙)___α(丙).
②达到平衡后,若向甲、乙两容器中分别通入少量且等量Ar气体,甲容器的化学平衡___移动,乙容器的化学平衡___移动.(填“正向”、“逆向”或“不”)
▼优质解答
答案和解析
(1)A.向装置中充入O2,氧气浓度增大,反应速率加快,平衡正向移动,二氧化硫转化率增大,故A正确;
B.升高温度,反应速率加快,正反应为放热反应,平衡逆向移动,二氧化硫转化率减小,故B错误;
C.向装置中充入N2,反应混合物各组分浓度不变,平衡不移动,二氧化硫转化率不变,故C错误;
D.向装置中充入过量的SO2,反应速率加快,但二氧化硫转化率降低,故D错误,
故选:A;
(2)①反应前4分钟,△n(O2)=
△n(SO3)=
×8mol=4mol,则v(O2)=
=0.5mol/(L.min),
故答案为:0.5mol/(L.min);
②6min到达平衡,平衡时三氧化硫为9.4mol,则:
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol):10 5 0
变化量(mol):9.4 4.7 9.4
平衡量(mol):0.6 0.3 9.4
500℃时平衡常数K=
=
=1636.3,
故答案为:1636.3;
(3)保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),转化到方程式左边得到6mol SO2、4mol O2,与原平衡中起始物质的量均为3:2,恒温恒压下,为等效平衡,平衡时相同物质的含量、浓度相等.
A.恒温恒压下下,体积之比等于物质的量之比,则平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,则:
2SO2(g)+O2(g)⇌2SO3(g)△n=1
起始量(mol):3 2 0
变化量(mol):1 0.5 1 5-4.5=0.5
平衡量(mol):2 1.5 1
故第一次平衡时反应放出的热量为196.6kJ×
=98.3 kJ,故A错误;
B.由A中计算可知,原平衡中二氧化硫的转化率为
,改变起始投入量,与原平衡为等效平衡,设平衡时二氧化硫转化为x,则:
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol):4 3.5 1
变化量(mol):4x 2x 2x
平衡量(mol):4-4x 3.5-x 1+2x
则
=
,解得x=
,二氧化硫的转化率减小,故B错误;
C.两次平衡为等效平衡,平衡时氧气体积分数相等,故C正确;
D.两次平衡为等效平衡,平衡时同种物质的含量相等,结合A中可知平衡时三氧化硫体积分数为
=
,故D正确,
故选:CD;
(4)①甲为恒温恒压,丙为恒容绝热,正反应为放热溶液,随反应进行丙中温度升高,升温平衡逆向移动,平衡常数减小,则K (甲)>K(丙),
乙为恒温恒容,等效为在丙的基础上降低温度,平衡正向移动,达到平衡时SO2的转化率:α(乙)>α(丙),
故答案为:>;>;
②甲为恒温恒压,通入氩气,体积增大,混合物各组分浓度减小,等效为减小压强,正反应为气体体积减小的反应,平衡逆向移动的;
乙为恒温恒容,通入氩气,混合物各组分浓度不变,平衡不移动,
故答案为:逆向;不.
B.升高温度,反应速率加快,正反应为放热反应,平衡逆向移动,二氧化硫转化率减小,故B错误;
C.向装置中充入N2,反应混合物各组分浓度不变,平衡不移动,二氧化硫转化率不变,故C错误;
D.向装置中充入过量的SO2,反应速率加快,但二氧化硫转化率降低,故D错误,
故选:A;
(2)①反应前4分钟,△n(O2)=
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 4min |
故答案为:0.5mol/(L.min);
②6min到达平衡,平衡时三氧化硫为9.4mol,则:
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol):10 5 0
变化量(mol):9.4 4.7 9.4
平衡量(mol):0.6 0.3 9.4
500℃时平衡常数K=
| c2(SO3) |
| c2(SO2)×c(O2) |
(
| ||||
(
|
故答案为:1636.3;
(3)保持同一反应温度,在相同容器中,将起始物质的量改为5mol SO2、3.5mol O2、1mol SO3(g),转化到方程式左边得到6mol SO2、4mol O2,与原平衡中起始物质的量均为3:2,恒温恒压下,为等效平衡,平衡时相同物质的含量、浓度相等.
A.恒温恒压下下,体积之比等于物质的量之比,则平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,则:
2SO2(g)+O2(g)⇌2SO3(g)△n=1
起始量(mol):3 2 0
变化量(mol):1 0.5 1 5-4.5=0.5
平衡量(mol):2 1.5 1
故第一次平衡时反应放出的热量为196.6kJ×
| 1mol |
| 2mol |
B.由A中计算可知,原平衡中二氧化硫的转化率为
| 1 |
| 3 |
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol):4 3.5 1
变化量(mol):4x 2x 2x
平衡量(mol):4-4x 3.5-x 1+2x
则
| 4-4x |
| 8.5-2x |
| 2 |
| 4.5 |
| 1 |
| 14 |
C.两次平衡为等效平衡,平衡时氧气体积分数相等,故C正确;
D.两次平衡为等效平衡,平衡时同种物质的含量相等,结合A中可知平衡时三氧化硫体积分数为
| 1mol |
| 4.5mol |
| 2 |
| 9 |
故选:CD;
(4)①甲为恒温恒压,丙为恒容绝热,正反应为放热溶液,随反应进行丙中温度升高,升温平衡逆向移动,平衡常数减小,则K (甲)>K(丙),
乙为恒温恒容,等效为在丙的基础上降低温度,平衡正向移动,达到平衡时SO2的转化率:α(乙)>α(丙),
故答案为:>;>;
②甲为恒温恒压,通入氩气,体积增大,混合物各组分浓度减小,等效为减小压强,正反应为气体体积减小的反应,平衡逆向移动的;
乙为恒温恒容,通入氩气,混合物各组分浓度不变,平衡不移动,
故答案为:逆向;不.
看了工业上以黄铁矿为原料生产硫酸,...的网友还看了以下:
低温下,反应CO(g)+NO2(g)==CO2(g)+NO(g)的速率方程是υ=k{c(NO2)} 2020-05-14 …
如图为速力菲补血剂的说明书.(1)琥珀酸亚铁的相对分子质量为.(2)琥珀酸亚铁中铁元素的质量分数为 2020-06-17 …
如图,边长为6cm的正方形ABCD中,点E、F、G分别从点A、B、C三点同时出发,沿矩形的边按逆时 2020-06-21 …
s=1/2*g*t^2(s为直线运动的距离s=1/2*g*t^2g为在地球上的加速度t为时间)s= 2020-07-22 …
一根铁链长为2L,重为2G,摊放在水平地面上.手拉铁链的一端向上提起,当铁链的另一端刚好离开地面时, 2020-11-20 …
汽车的加速度为1.0g(g为重力加速度).是什么原因啊?设地面附着系数为0.8,经试验后分析得出,汽 2020-11-21 …
加速度传感器的灵敏度为100mv/g,转换为速度的灵敏度(即单位为mv/mm/s)应该是多少?怎么求 2020-12-05 …
空气的声速为,钢铁的声速为.两个人分别在铁路两端,一人用锤子敲一下铁路,一人在另一端听到两声响,间隔 2020-12-09 …
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O 2020-12-22 …
如下图所示,固定于水平面上的光滑平行导电轨道AB、CD上放着两根细金属棒ab、cd。当一条形磁铁自上 2021-01-13 …