早教吧作业答案频道 -->化学-->
氯酸钠(NaClO3)是无机盐工业的重要产品之一.(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的(填试剂化学式),过滤后即可得到.(2)
题目详情
氯酸钠(NaClO3)是无机盐工业的重要产品之一.
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的___(填试剂化学式),过滤后即可得到.
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
5NaC1+NaC1O3+3H2O
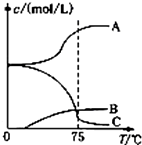
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如图表1所示,图中C表示的离子是___.(填离子符号)
图表(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则阳极反应式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,记录消耗消耗K2Cr2O7标准溶液的体积.
步骤4:为精确测定样品中C1O3-的质量分数,重复上述步骤2、3操作2-3次.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;
静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③用0.0200mol/L K2Cr2O7标准溶液滴定的目的是___.
④在上述操作无误的情况下,所测定的结果偏高,其可能的原因是___.

(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的___(填试剂化学式),过滤后即可得到.
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
| ||
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如图表1所示,图中C表示的离子是___.(填离子符号)
图表(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠.则阳极反应式为:___.
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液.
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min.
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,记录消耗消耗K2Cr2O7标准溶液的体积.
步骤4:为精确测定样品中C1O3-的质量分数,重复上述步骤2、3操作2-3次.
步骤5:数据处理与计算.
①步骤2中反应的离子方程式为___;
静置10min的目的是___.
②步骤3中K2Cr2O7标准溶液应盛放在___(填仪器名称)中.
③用0.0200mol/L K2Cr2O7标准溶液滴定的目的是___.
④在上述操作无误的情况下,所测定的结果偏高,其可能的原因是___.
▼优质解答
答案和解析
(1)热的石灰乳通入氯气,反应的方程式为:2Cl2+2Ca(OH)2
CaCl2+Ca(ClO)2+2H2O,除去CaCl2后主要成分为Ca(ClO)2,要加入钠盐得到NaClO3,应加入Na2CO3,发生复分解反应生成碳酸钙沉淀,
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,阳极发生氧化反应,电极方程式为Cl--6e-+6OH-=C1O3-+3H2O,故答案为:Cl--6e-+6OH-=C1O3-+3H2O;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,静置10min可以使亚铁离子和ClO3-充分反应,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③K2Cr2O7具有氧化性,与亚铁离子反应,可确定步骤②消耗的(NH4)2Fe(SO4)2的量,故答案为:计算步骤②消耗的(NH4)2Fe(SO4)2的量;
④如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
| ||
故答案为:Na2CO3;
(2)氯气与氢氧化钠反应温度低时生成NaClO,温度高时生成NaC1O3,图中C的浓度随着温度的升高而减小,所以C代表ClO-;
故答案为:ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,阳极发生氧化反应,电极方程式为Cl--6e-+6OH-=C1O3-+3H2O,故答案为:Cl--6e-+6OH-=C1O3-+3H2O;
(4)①酸性条件下,亚铁离子被ClO3-氧化为铁离子,自身被还原为氯离子,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,静置10min可以使亚铁离子和ClO3-充分反应,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;使溶液中C1O3-与Fe2+反应充分完全;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以应该用酸式滴定管盛放;
故答案为:酸式滴定管;
③K2Cr2O7具有氧化性,与亚铁离子反应,可确定步骤②消耗的(NH4)2Fe(SO4)2的量,故答案为:计算步骤②消耗的(NH4)2Fe(SO4)2的量;
④如果溶液中的Fe2+被空气中的氧气,则溶液中Fe2+的浓度会减小,在滴定时消耗的(NH4)2Fe(SO4)2溶液的体积会偏大,所以测定的结果偏高;
故答案为:溶液中的Fe2+被空气中的氧气氧化.
看了 氯酸钠(NaClO3)是无机...的网友还看了以下:
哺乳期钙片哪个牌子好 首选这4款补钙效果超一流 2020-03-29 …
生石灰加一定的水得到石灰乳为什么不是得到澄清石灰水CACO3锻造生成CAO加水后生成caoh2中后 2020-04-07 …
保健品“钙尔奇D”中,其主要成分是碳酸钙(化学式为CaCO3).计算:(1)碳酸钙中钙、碳、氧的质 2020-04-11 …
如图为某钙片的标签.(1)该钙片的主要成分为碳酸钙,碳酸钙不溶于水,却能为人体补充一定量的钙离子, 2020-04-11 …
为什么在溶洞里石钟乳上和石笋上碳酸钙沉积而在地表是碳酸钙溶蚀呢?可是在石钟乳的下端和石笋的上端并没 2020-05-16 …
好的追加30不准复制网上的,我的题不一样人体中的钙元素主要以羟基磷酸钙晶体[Ca10(PO4)6( 2020-05-17 …
一杯500克的牛奶中含有3/2500的钙质,这些钙质约占一个成年人一天所需钙质的3/4.一个成年人 2020-06-04 …
一杯500克的牛奶中含有3/2500的钙质,这些钙质约占一个成年人一天所需钙质的3/4.一个成年人 2020-06-04 …
钙及其化合物在生产、生活中具有广泛的应用(一)钙的广泛用途(1)高钙奶中含钙,这里的钙是指.(选填 2020-06-12 …
如果8块牛奶饼干的钙含量,相当于一杯牛奶的钙含量小芳的爸爸早餐吃了二十块饼干,喝了两杯牛奶,钙含量 2020-06-13 …