早教吧作业答案频道 -->化学-->
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:请回答下列问题:(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加
题目详情
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
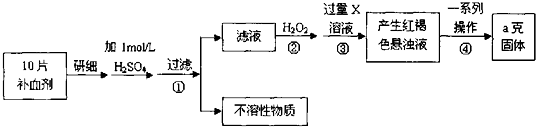
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:___.
(2)步骤②加入过量H2O2的目的是___.
(3)步骤③中反应的离子方程式___.
(4)步骤④中一系列处理的操作步骤:过滤、___、灼烧、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量___g.
(6)该小组有些同学认为将KMnO4溶液滴入滤液也能进行铁元素含量的测定.
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是___.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.浓硝酸
③恰好反应完时的溶液颜色为___色.
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天服用___mgFeSO4•7H2O的片剂.

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:___.
(2)步骤②加入过量H2O2的目的是___.
(3)步骤③中反应的离子方程式___.
(4)步骤④中一系列处理的操作步骤:过滤、___、灼烧、称量.
(5)若实验无损耗,则每片补血剂含铁元素的质量___g.
(6)该小组有些同学认为将KMnO4溶液滴入滤液也能进行铁元素含量的测定.
(5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需___
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是___.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.浓硝酸
③恰好反应完时的溶液颜色为___色.
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4•7H2O的片剂来补充铁,则正常人每天服用___mgFeSO4•7H2O的片剂.
▼优质解答
答案和解析
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl-,溶液变为血红色,发生Fe3++3SCN-⇌Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水,反应离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤、干燥得到氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤、干燥;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
=0.07ag,故答案为:0.07a;
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,故答案为:250mL容量瓶;
②稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选B,
故答案为:B;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,
故答案为:紫;
(7)正常人每天应补充14mg左右的铁,则每天约需要服用含FeSO4•7H2O的质量=
×100%=69.5mg,
故答案为:69.5mg;
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl-,溶液变为血红色,发生Fe3++3SCN-⇌Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,2H++H2O2+2Fe2+=2Fe3++2H2O,
故答案为:将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水,反应离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤、干燥得到氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤、干燥;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×
| ||
| 10 |
(6)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管,250mL容量瓶,故答案为:250mL容量瓶;
②稀硝酸、浓硝酸具有强氧化性,含有氧化Fe2+,高锰酸钾可以氧化HCl为氯气,故选硫酸酸化,故选B,
故答案为:B;
③高锰酸钾为紫色,当滴定到终点时,Fe2+被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色为紫色,
故答案为:紫;
(7)正常人每天应补充14mg左右的铁,则每天约需要服用含FeSO4•7H2O的质量=
| 14mg | ||
|
故答案为:69.5mg;
看了硫酸亚铁晶体(FeSO4•7H...的网友还看了以下:
分式求和问题1/(2^k+1)+1/(2^k+2)+…+1/2^(k+1)为什么1/(2^k+1) 2020-04-26 …
为了除去酸性ZnCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,使溶液的pH升高,过滤 2020-05-13 …
天然水净化为自来水的主要流程如下:(1)下列说法不正确的是(填字母).A.过滤池可以除去难溶性杂质 2020-05-13 …
下列操作正确的是()A.过滤时,液面要高于滤纸边缘B.过滤时,要用玻璃棒在漏斗中不时地搅拌,加快过 2020-05-16 …
将7.33gNaCl和Na2SO4的固体混合物溶于85g水中,滴入10gBaCl2溶液恰好沉淀完全 2020-05-20 …
用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4•H2O的工艺流程如下 2020-06-11 …
若关于x的方程x-7分之x-8-7-x分之k=8有增根,则k=.(x-7)/(x-8)-(7-x) 2020-07-31 …
西方经济学微观部分生产理论简单大题求解已知某厂商生产函数为Q=L^3/7*K^4/7求MPLMPK答 2020-11-21 …
如图是过滤器的制作和过滤装置图,则下列有关说法错误的是()A.图中制过滤器时加水湿润,是为了使滤纸能 2020-12-02 …
把铁粉和氧化铜的混合物加入到一定量的盐酸中,充分反应后,过滤.在滤液中加入少量铁粉,无现象.则下列判 2020-12-24 …