早教吧作业答案频道 -->化学-->
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.(1)试写出该反应的化学方程式(Ⅰ):.(2)该反应体系中还伴随着
题目详情
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.
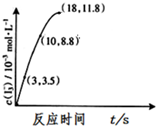
(1)试写出该反应的化学方程式(Ⅰ):___.
(2)该反应体系中还伴随着化学反应(Ⅱ):I2(aq)+I-(aq)⇌I3-(aq).
反应Ⅱ的平衡常数表达式为:___.
(3)根据如图,计算反应Ⅱ中3-18s内用I2表示的反应速率为___.为探究Fe2+对上述O3氧化I-反应的影响,将O3通入含Fe2+和 I-的混合溶液中.
(4)试预测因Fe2+的存在可能引发的化学反应(请用文字描述,如:“碘离子被臭氧氧化为碘单质”)
①___.
②___;该反应的过程能显著降低溶液的pH,并提高反应(Ⅰ)中Ⅰ-的转化率,原因是:___.
(5)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢铁中的硫转化为H2SO3,然后以淀粉为指示剂,用一定浓度的I2溶液进行滴定.综合上述各步反应及已有知识,可推知氧化性强弱关系正确的是___(填序号).
a.Fe3+>I2 b.O3>Fe3+ c.I2>O2 d.I2>SO42-.

(1)试写出该反应的化学方程式(Ⅰ):___.
(2)该反应体系中还伴随着化学反应(Ⅱ):I2(aq)+I-(aq)⇌I3-(aq).
反应Ⅱ的平衡常数表达式为:___.
(3)根据如图,计算反应Ⅱ中3-18s内用I2表示的反应速率为___.为探究Fe2+对上述O3氧化I-反应的影响,将O3通入含Fe2+和 I-的混合溶液中.
(4)试预测因Fe2+的存在可能引发的化学反应(请用文字描述,如:“碘离子被臭氧氧化为碘单质”)
①___.
②___;该反应的过程能显著降低溶液的pH,并提高反应(Ⅰ)中Ⅰ-的转化率,原因是:___.
(5)利用I2的氧化性可测定钢铁中硫的含量.做法是将钢铁中的硫转化为H2SO3,然后以淀粉为指示剂,用一定浓度的I2溶液进行滴定.综合上述各步反应及已有知识,可推知氧化性强弱关系正确的是___(填序号).
a.Fe3+>I2 b.O3>Fe3+ c.I2>O2 d.I2>SO42-.
▼优质解答
答案和解析
(1)臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘,反应的离子方程式为:O3+2KI+H2O→O2+I2+2KOH,
故答案为:O3+2KI+H2O→O2+I2+2KOH;
(2)反应I2(aq)+I-(aq)⇌I3-(aq)的平衡常数表达式为:K=
,
故答案为:
;
(3)反应Ⅱ中3-18s内I3-的浓度变化为:11.8mol/L-3.5mol/L=8.3×10-3mol/L,则反应Ⅱ中3-18s内用I3-表示的反应速率为:v(I3-)=
=5.5×10-3mol•L-1•s-1,化学反应速率与化学计量数成正比,则v(I3-)=v(I2)=
=5.5×10-3mol•L-1•s-1,
故答案为:5.5×10-3mol•L-1•s-1;
(4)①Fe2+的还原性较强,则亚铁离子被臭氧氧化为铁离子,
故答案为:亚铁离子被臭氧氧化为铁离子;
②铁离子在溶液中易发生水解反应生成氢氧化铁,该过程中消耗OH-,使反应I的平衡向着正反应方向移动,促进I-转化,提高了反应(Ⅰ)中Ⅰ-的转化率,
故答案为:铁离子水解生成氢氧化铁沉淀;Fe3+形成Fe(OH)3过程中消耗OH-,使反应I的平衡向着正反应方向移动,促进I-转化;
(5)利用I2的氧化性可测定钢铁中硫的含量,发生反应为H2SO3+I2+H2O=4H++SO42-+2I-,证明氧化性I2>SO42-;结合以上分析及已知知识还可知氧化性:Fe3+>I2、O3>Fe3+,
故答案为:a b d.
故答案为:O3+2KI+H2O→O2+I2+2KOH;
(2)反应I2(aq)+I-(aq)⇌I3-(aq)的平衡常数表达式为:K=
| c(I3-) |
| c(I2)•c(I-) |
故答案为:
| c(I3-) |
| c(I2)•c(I-) |
(3)反应Ⅱ中3-18s内I3-的浓度变化为:11.8mol/L-3.5mol/L=8.3×10-3mol/L,则反应Ⅱ中3-18s内用I3-表示的反应速率为:v(I3-)=
| 8.3×10-3mol/L |
| 15s |
| 8.3×10-3mol/L |
| 15s |
故答案为:5.5×10-3mol•L-1•s-1;
(4)①Fe2+的还原性较强,则亚铁离子被臭氧氧化为铁离子,
故答案为:亚铁离子被臭氧氧化为铁离子;
②铁离子在溶液中易发生水解反应生成氢氧化铁,该过程中消耗OH-,使反应I的平衡向着正反应方向移动,促进I-转化,提高了反应(Ⅰ)中Ⅰ-的转化率,
故答案为:铁离子水解生成氢氧化铁沉淀;Fe3+形成Fe(OH)3过程中消耗OH-,使反应I的平衡向着正反应方向移动,促进I-转化;
(5)利用I2的氧化性可测定钢铁中硫的含量,发生反应为H2SO3+I2+H2O=4H++SO42-+2I-,证明氧化性I2>SO42-;结合以上分析及已知知识还可知氧化性:Fe3+>I2、O3>Fe3+,
故答案为:a b d.
看了臭氧是一种强氧化剂可与碘化钾水...的网友还看了以下:
某同学做氢氧化钙溶液与碳酸钠溶液反应的实验,该反应的化学方程式是.为使反应完全,先往氢氧化钙溶液中 2020-04-08 …
(1)如图1装置为以NaOH溶液为电解质溶液的氢氧燃料电池.装置1中a和b为气体进口,其中a口进入 2020-05-13 …
(1)向FeCl3溶液和FeCl2溶液中分别加入NaClO、NaCl、NaOH混合溶液,结果都产生 2020-05-13 …
过氧化钠与硫化氢反应方程式?溶液为什么变混浊? 2020-05-16 …
(2008•烟台)印刷铜制电路板的“腐蚀液”为FeCl3溶液.已知铜、铁均能与FeCl3溶液反应, 2020-07-10 …
(9分)向橙色的溴水中撒入足量的镁粉,充分振荡后过滤,溶液呈现色,原因是。若向滤液中加入适量的氯水 2020-07-12 …
饱和KCIO3溶液与KI溶液,逐滴加入9MOL/L的硫酸,期间各阶段的化学方程式溶液颜色是由黄色I 2020-07-20 …
(1)K2Cr2O7(橙色)在水中会部分转化为K2CrO4(黄色),该过程可用离子反应方式表示为:; 2020-11-03 …
耐盐植物细胞的液泡膜上有一种载体蛋白,能将Na+逆浓度梯度运入液泡内,从而降低了Na+对细胞质中酶活 2020-12-14 …
久置在空气中的氢氧化钠溶液,会吸收空气中的二氧化碳,生成一种盐类杂质,该反应原理可用化学方程式表示为 2021-01-18 …