早教吧作业答案频道 -->化学-->
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是.(填字母)A.HCHO与水分子间能形成氢键B.HCHO和CO2分子中的中心原子均采用sp2杂化C.苯分子中含有6个
题目详情
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
(1)下列叙述正确的是___.(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
Mn元素价电子排布式为___,气态 Mn2+再失去一个电子比气态 Fe2+再失去一个电子难,其原因是___.
(3)铁原子核外有___种运动状态不同的电子.
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于___区.
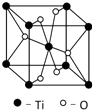
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为___.
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为___
②与CNO-互为等电子体微粒的化学式为___(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式___.

(1)下列叙述正确的是___.(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)铁原子核外有___种运动状态不同的电子.
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于___区.
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为___.
(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为___
②与CNO-互为等电子体微粒的化学式为___(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式___.
▼优质解答
答案和解析
(1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键,故A正确;
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;
C.C6H6分子中含有12个σ键和1个大π键,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2,
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Fe原子核外电子数为26,原子核外没有运动状态相同的电子,即铁原子核外有26种运动状态不同的电子,
故答案为:26;
(4)Ti处于第四周期第ⅣB族,属于d区元素,
故答案为:d;
(5)每个晶胞中含有钛原子数为8×
+1=2,氧原子数为4×
+2=4,故化学式为TiO2,
故答案为:TiO2;
(6)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为H<C<N<O,
故答案为:H<C<N<O;
②与CNO-互为等电子体微粒含有3个原子、价电子总数为16,故与CNO-互为等电子体微粒的化学式CO2、N2O、SCN-等,
故答案为:CO2或N2O或SCN-;
③碳形成4个共价键,氮为三个共价键,氧形成2个共价键,氢形成1个共价键,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H,
故答案为:N≡C-O-H.
B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;
C.C6H6分子中含有12个σ键和1个大π键,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2,
Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Fe原子核外电子数为26,原子核外没有运动状态相同的电子,即铁原子核外有26种运动状态不同的电子,
故答案为:26;
(4)Ti处于第四周期第ⅣB族,属于d区元素,
故答案为:d;
(5)每个晶胞中含有钛原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:TiO2;
(6)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为H<C<N<O,
故答案为:H<C<N<O;
②与CNO-互为等电子体微粒含有3个原子、价电子总数为16,故与CNO-互为等电子体微粒的化学式CO2、N2O、SCN-等,
故答案为:CO2或N2O或SCN-;
③碳形成4个共价键,氮为三个共价键,氧形成2个共价键,氢形成1个共价键,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H,
故答案为:N≡C-O-H.
看了第四周期过渡元素Mn、Fe、T...的网友还看了以下:
帮拟一个标题期待是什么?有人说,期待是希望;有人说,期待是美好事物的源泉;有人说,期待是人成功的引 2020-06-21 …
某企业拥有一张期限为6个月的商业汇票,本金80万元,月息8‰,某企业拥有一张期限为6个月的商业汇票 2020-07-01 …
一道持有至到期题,算出来跟答案对不上,我怀疑答案错了,麻烦您给看看10.甲公司20×6年1月1日购 2020-07-16 …
植物有思维吗?植物真的有感情吗?方舟子(原载《牛顿-科学世界》2002年第6期)--------- 2020-07-25 …
某年级星期二下午3点是体育兴趣活动,星期三下午3点是艺术兴趣活动,据统计某班有5/6的同学参加体育 2020-08-03 …
已知9月1日是星期四,则从9月1日起到11月8日之间共有()个星期二.答案C.解析:根据条件,可知 2020-08-03 …
星期六星期天怎样复习6科--初三下个星期模拟考了,想在这两天好好复习一下,但是有点迷茫,并且我成绩 2020-08-03 …
财务管理:已知:A公司拟购买某公司债券作为长期投资(打算持有至到期日),要求的必要收益率为6%已知: 2020-11-05 …
分期期数费率:分期期数费率:单笔18期:12.6%财智金18期:13.5%单笔24期:17.28%财 2020-11-06 …
分期期数费率:分期期数费率:单笔18期:12.6%财智金18期:13.5%单笔24期:17.28%财 2020-11-06 …