早教吧作业答案频道 -->化学-->
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.(1)化合物LiNH2是一种储氢容量高、安全性好的固体储氢材料,其储氢原理表示为:Li2NH(s)+H2(g)=LiNH2(s)+LiH
题目详情
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
(1)化合物 LiNH2是一种储氢容量高、安全性好的固体储氢材料,其储氢原理表示为:
Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
①LiNH2的电子式___.
②写出Li3N固体与氢气反应转化为LiNH2的热化学方程式___.
(2)乙苯催化生产苯乙烯可得到H2副产物,反应如下:
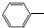 CH2CH3(g)⇌催化剂
CH2CH3(g)⇌催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)
在实际生产时,反应在常压(101KPa)下进行,且向乙苯蒸气中掺入水蒸气.图1是不同温度和不同投料比[M=n(H2O)n(乙苯)]情况下,乙苯平衡转化率的变化曲线.
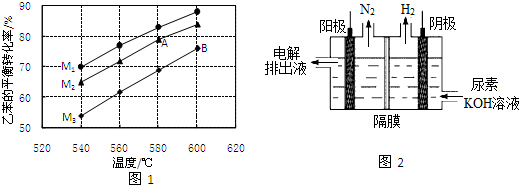
①用平衡分压代替平衡浓度,列出540℃下该反应的平衡常数计算式K=___.(分压=总压×物质的量分数)
②图中A、B两点对应的平衡常数大小:KA___KB.(填“>”、“<”或“=”)
③投料比(M1、M2、M3)的大小顺序为___.判断理由为___.
④随着反应的进行,催化剂上出现少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示).
(3)电解碱性尿素[CO(NH2)2]溶液可以制得氢气,装置如图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为___.
(1)化合物 LiNH2是一种储氢容量高、安全性好的固体储氢材料,其储氢原理表示为:
Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
①LiNH2的电子式___.
②写出Li3N固体与氢气反应转化为LiNH2的热化学方程式___.
(2)乙苯催化生产苯乙烯可得到H2副产物,反应如下:
 CH2CH3(g)⇌催化剂
CH2CH3(g)⇌催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)在实际生产时,反应在常压(101KPa)下进行,且向乙苯蒸气中掺入水蒸气.图1是不同温度和不同投料比[M=n(H2O)n(乙苯)]情况下,乙苯平衡转化率的变化曲线.

①用平衡分压代替平衡浓度,列出540℃下该反应的平衡常数计算式K=___.(分压=总压×物质的量分数)
②图中A、B两点对应的平衡常数大小:KA___KB.(填“>”、“<”或“=”)
③投料比(M1、M2、M3)的大小顺序为___.判断理由为___.
④随着反应的进行,催化剂上出现少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示).
(3)电解碱性尿素[CO(NH2)2]溶液可以制得氢气,装置如图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为___.
▼优质解答
答案和解析
(1)①LiNH2为离子化合物,是锂离子Li+和NH2-离子构成,电子式为: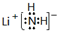 ,
,
故答案为: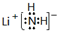 ;
;
②Ⅰ.Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Ⅱ.Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ得到Li3N固体与氢气反应转化为LiNH2的热化学方程式:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1 ,
故答案为:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1;
(2)① CH2CH3(g)
CH2CH3(g)
 CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),
用平衡分压代替平衡浓度,540℃下乙苯转化率为70%,设起始乙苯物质的量为1mol,
 CH2CH3(g)
CH2CH3(g)
 CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),
起始量(mol) 1mol 0 0
变化量(mol) 1mol×70%=0.7mol 0.7mol 0.7mol
平衡量(mol) 0.3mol 0.7mol 0.7mol
540℃下该反应的平衡常数计算式K=
=
,
故答案为:
;
②图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,
故答案为:<;
③乙苯量越多,投料比越小,乙苯转化率越小,恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动,据此分析判断M的值,M1>M2>M3,
故答案为:M1>M2>M3;恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动;
④催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳,反应的化学方程式为:C+H2O
CO+H2,
故答案为:C+H2O
CO+H2.
(3)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
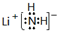 ,
,故答案为:
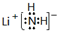 ;
;②Ⅰ.Li2NH (s)+H2(g)=LiNH2 (s)+LiH(s)△H=-44.5kJ•mol-1
Ⅱ.Li3N (s)+H2(g)=Li2NH (s)+LiH(s)△H=-165kJ•mol-1
依据盖斯定律计算Ⅰ+Ⅱ得到Li3N固体与氢气反应转化为LiNH2的热化学方程式:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1 ,
故答案为:Li3N (s)+2H2(g)=LiNH2 (s)+2LiH(s)△H=-209.5kJ•mol-1;
(2)①
 CH2CH3(g)
CH2CH3(g)
| ||
 CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),用平衡分压代替平衡浓度,540℃下乙苯转化率为70%,设起始乙苯物质的量为1mol,
 CH2CH3(g)
CH2CH3(g)
| ||
 CH=CH2(g)+H2(g),
CH=CH2(g)+H2(g),起始量(mol) 1mol 0 0
变化量(mol) 1mol×70%=0.7mol 0.7mol 0.7mol
平衡量(mol) 0.3mol 0.7mol 0.7mol
540℃下该反应的平衡常数计算式K=
| ||||
|
(
| ||
|
故答案为:
(
| ||
|
②图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,
故答案为:<;
③乙苯量越多,投料比越小,乙苯转化率越小,恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动,据此分析判断M的值,M1>M2>M3,
故答案为:M1>M2>M3;恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动;
④催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性是因为碳和水蒸气在高温下反应生成一氧化碳气体和氢气,除去表面的积碳,反应的化学方程式为:C+H2O
| ||
故答案为:C+H2O
| ||
(3)由图可知,CO(NH2)2在阳极放电生成N2,C元素价态未变化,故还有碳酸钾生成与水生成;阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
看了氢气是一种清洁能源,氢气的制取...的网友还看了以下:
一般地,设函数f(x)的定义域为I:如果对于定义域I内某个区间D上的两个自变量的值x1,x2,当x1 2020-03-30 …
一般地,设函数f(x)的定义域为I如果对于属于I内某个区间上的任意两个自变量的值x1、x2,当x1< 2020-03-30 …
一般地,设函数y=f(x)的定义域为I,如果存在实数M满足:①对于任意的x∈I,都有f(x)≤M; 2020-06-25 …
(求高手解惑)二重积分I=∫∫Dxsinydxdy,D={(x,y)|1≤x≤2,0≤y≤π/2} 2020-07-31 …
扩充复平面上的概念:无穷远点的邻域:N(∞)={z|IzI>1/ε}这我不懂.∞的ε领域不是I∞- 2020-07-31 …
一般的,设函数Y=F(x)的定义域为I,如果存在实数M满足:(1)对于任意的x∈I,都有F(x)≤ 2020-08-01 …
哪些代数数域中素因数的唯一分解性成立?又在哪些数域中不成立?怎么判定?如题.比如,有理数域中的整数素 2020-11-02 …
氘在化学、医药学及生物学等领域有广泛使用,也是制造氢弹和中子弹最重要的原料,1967年6月17日我国 2020-11-15 …
函数最大值为什么一般的,设函数Y=f(X)的定义域为I,如果存在实数M满足(1)对于任意的X属于I, 2020-12-08 …
如何求函数的最大值与最小值??就是数学必修一里面的内容:一般地,设函数y=f(x)的定义域为I,如果 2021-01-16 …