早教吧作业答案频道 -->化学-->
氢气作为高效、洁净的二次能源,将成为未来社会的主要能源之一.甲烷重整是一种被广泛使用的制氢工艺.Ⅰ.甲烷水蒸气重整制氢气的主要原理:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+2
题目详情
氢气作为高效、洁净的二次能源,将成为未来社会的主要能源之一.甲烷重整是一种被广泛使用的制氢工艺.
Ⅰ.甲烷水蒸气重整制氢气的主要原理:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206kJ•mol-1…①
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=-41kJ•mol-1…②
(1)反应①的平衡常数的表达式K=___.
(2)有研究小组通过应用软件AsepnPlus实现了对甲烷水蒸气重整制氢系统的模拟,研究了控制水反应水碳比,在不同温度下反应器RI中操作压力变化对氢气产率的影响,其数据结果如图1所示:
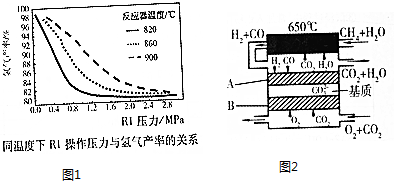
①请根据图象,阐述在一定压力条件下温度与氢气产率的关系,并说明原因___;
②在实际工业生产中,操作压力一般控制在2.0-2.8MPa之间,其主要原因是___.
Ⅱ.甲烷二氧化碳重整
(3)近年来有科学家提出高温下利用CO2对甲烷蒸汽进行重整,既可以制氢也可以减少CO2排放缓解温室效应,其主要原理为CH4(g)+CO2(g)⇌2CO(g)+2H2(g),该反应的△H=___kJ•mol-1.经研究发现该工艺与Ⅰ相比,主要问题在于反应过程中更容易形成积碳而造成催化剂失活,请用化学方程式表示形成积碳的原因___.
Ⅲ.甲烷水蒸气重整的应用
(4)甲烷水蒸气重整的一个重要应用是将甲烷水蒸气重整后的合成气作为熔融碳酸盐燃料电池的原料,其工作原理如图2:
①写出该电池的负极反应方程式___;
②该电池中可循环利用的物质有___;
③若该燃料电池的能量转化效率为70%,则当1g甲烷蒸汽通入电池时,理论上外电路可以产生___C(库仑)的电量.(电子电量为1.6×10-19C)
Ⅰ.甲烷水蒸气重整制氢气的主要原理:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=+206kJ•mol-1…①
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=-41kJ•mol-1…②
(1)反应①的平衡常数的表达式K=___.
(2)有研究小组通过应用软件AsepnPlus实现了对甲烷水蒸气重整制氢系统的模拟,研究了控制水反应水碳比,在不同温度下反应器RI中操作压力变化对氢气产率的影响,其数据结果如图1所示:

①请根据图象,阐述在一定压力条件下温度与氢气产率的关系,并说明原因___;
②在实际工业生产中,操作压力一般控制在2.0-2.8MPa之间,其主要原因是___.
Ⅱ.甲烷二氧化碳重整
(3)近年来有科学家提出高温下利用CO2对甲烷蒸汽进行重整,既可以制氢也可以减少CO2排放缓解温室效应,其主要原理为CH4(g)+CO2(g)⇌2CO(g)+2H2(g),该反应的△H=___kJ•mol-1.经研究发现该工艺与Ⅰ相比,主要问题在于反应过程中更容易形成积碳而造成催化剂失活,请用化学方程式表示形成积碳的原因___.
Ⅲ.甲烷水蒸气重整的应用
(4)甲烷水蒸气重整的一个重要应用是将甲烷水蒸气重整后的合成气作为熔融碳酸盐燃料电池的原料,其工作原理如图2:
①写出该电池的负极反应方程式___;
②该电池中可循环利用的物质有___;
③若该燃料电池的能量转化效率为70%,则当1g甲烷蒸汽通入电池时,理论上外电路可以产生___C(库仑)的电量.(电子电量为1.6×10-19C)
▼优质解答
答案和解析
Ⅰ.(1)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数为K=
,
故答案为:K=
;
(2)①升高温度,主要反应是吸热反应,平衡向吸热的正反应方向移动,氢气的产率提高;
故答案为:升高温度,主要反应是吸热反应,平衡向吸热的正反应方向移动,氢气的产率提高;
②反应在低压下,有利氢气的产率提高,但反应速率慢,效益低,压强大,对设备材料强度要求高,故选择操作压力一般控制在2.0-2.8MPa之间为宜;
故答案为:反应在低压下,有利氢气的产率提高,但反应速率慢,效益低,压强大,对设备材料强度要求高;
Ⅱ.(3)根据盖斯定律,反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)△H=41KJ•mol-1+206KJ•mol-1=+247KJ•mol-1,在高温下,甲烷易分解成碳,
故答案为:+247•mol-1;CH4
C+2H2;
Ⅲ.(4)①负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO32--2e-=H2O+CO2,CO+CO32--2e-=2CO2,
故答案为:H2+CO32--2e-=H2O+CO2,CO+CO32--2e-=2CO2;
②负极反应式为CH4+4CO32--8e-=2H2O+5CO2,根据图知,二氧化碳有使电池稳定运行,电池的电解质组成应保持恒定作用,该电池中可循环利用的物质有CO2、H2O,
故答案为:CO2、H2O.
③当1g甲烷蒸汽通入电池时,根据电极反应:CH4+4CO32--8e-=2H2O+5CO2,理论上通过导线的电子的数目为
×8×6.02×1023×70%×1.6×10-19C=33712C,故答案为:33712.
| c(CO)•c3(H2) |
| c(CH4)•c(H2O) |
故答案为:K=
| c(CO)•c3(H2) |
| c(CH4)•c(H2O) |
(2)①升高温度,主要反应是吸热反应,平衡向吸热的正反应方向移动,氢气的产率提高;
故答案为:升高温度,主要反应是吸热反应,平衡向吸热的正反应方向移动,氢气的产率提高;
②反应在低压下,有利氢气的产率提高,但反应速率慢,效益低,压强大,对设备材料强度要求高,故选择操作压力一般控制在2.0-2.8MPa之间为宜;
故答案为:反应在低压下,有利氢气的产率提高,但反应速率慢,效益低,压强大,对设备材料强度要求高;
Ⅱ.(3)根据盖斯定律,反应CO2(g)+CH4(g)⇌2CO(g)+2H2(g)△H=41KJ•mol-1+206KJ•mol-1=+247KJ•mol-1,在高温下,甲烷易分解成碳,
故答案为:+247•mol-1;CH4
| ||
Ⅲ.(4)①负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO32--2e-=H2O+CO2,CO+CO32--2e-=2CO2,
故答案为:H2+CO32--2e-=H2O+CO2,CO+CO32--2e-=2CO2;
②负极反应式为CH4+4CO32--8e-=2H2O+5CO2,根据图知,二氧化碳有使电池稳定运行,电池的电解质组成应保持恒定作用,该电池中可循环利用的物质有CO2、H2O,
故答案为:CO2、H2O.
③当1g甲烷蒸汽通入电池时,根据电极反应:CH4+4CO32--8e-=2H2O+5CO2,理论上通过导线的电子的数目为
| 1g |
| 16g/mol |
看了氢气作为高效、洁净的二次能源,...的网友还看了以下:
氨气的水溶液称为氨水,它的主要存在微粒是NH3•H2O.已知:a.常温下,醋酸和NH3•H2O的电 2020-05-16 …
(1)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3•H2O.已知:a.常温下,醋酸和NH3 2020-05-16 …
锗是重要的半导体材料,应用于航空航天测控、光纤通讯等领域.一种提纯二氧化锗粗品(主要含GeO2、A 2020-06-17 …
二氧化碳是一种宝贵的碳氧资源.一定条件下,二氧化碳转变成燃料甲醇(CH3OH)的化学方程式为CO2 2020-07-14 …
环己酮是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.+Na2Cr2O7+H2SO455℃~ 2020-11-04 …
二氧化碳是一种宝贵的碳氧资源.用二氧化碳和氨气合成尿素[化学式为CO(NH2)2]是固定和利用二氧化 2020-12-18 …
我们说王阳明的心学已经走向极端,主要是指这种学说()A.极力维护君主专制B.主张意识第一,物质第二C 2021-01-18 …
天然气的主要成分是甲烷.在某平衡体系中存在CH4、H2O、CO、H2四种气体,其平衡常数表达式为k= 2021-01-22 …
干粉灭火器中干粉的主要成分是碳酸氢钠(NaHCO3),受热时分解生成碳酸钠(Na2CO3)、水和二氧 2021-02-09 …
已知二氧化碳与氢氧化钠、氢氧化钙均可反应:2NaOH+CO2═Na2CO3+H2O;Ca(OH)2+ 2021-02-15 …