早教吧作业答案频道 -->化学-->
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.(1)下列关于SO2的说法正确的是.A.SO2使溴水褪色,体现出SO2的漂白性B.SO2通入紫色石蕊试液中,先变红后褪色C.SO2和Cl2混
题目详情
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料.
(1)下列关于SO2的说法正确的是___.
A.SO2使溴水褪色,体现出SO2的漂白性
B.SO2通入紫色石蕊试液中,先变红后褪色
C.SO2和Cl2混合通入品红溶液,品红一定褪色
D.SO2通入BaCl2溶液中无明显现象,SO2和NH3或NO2混合通入该溶液中,均会生成白色沉淀
(2)工业上常以SO2为原料制取H2SO4.现用如图所列各装置设计实验,实现碳和浓硫酸的反应并验证各种反应产物:
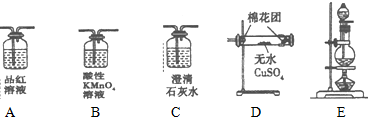
这些装置的连接顺序(按产物气.流从左至右的方向)是(填装置的编号):
___→___→___→___→___→___
(3)保险粉(Na2S2O4)广泛用于印染行业和食品储存行业.可以将SO2通入草酸钠(Na2C2O4)和足量NaOH的混合溶液中制取保险粉.离子方程式为___
(4)工业尾气中的SO2可在铜的作用下催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2-2n)H2O=2nCuSO4+(2-2n)H2SO4每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为___g.
(1)下列关于SO2的说法正确的是___.
A.SO2使溴水褪色,体现出SO2的漂白性
B.SO2通入紫色石蕊试液中,先变红后褪色
C.SO2和Cl2混合通入品红溶液,品红一定褪色
D.SO2通入BaCl2溶液中无明显现象,SO2和NH3或NO2混合通入该溶液中,均会生成白色沉淀
(2)工业上常以SO2为原料制取H2SO4.现用如图所列各装置设计实验,实现碳和浓硫酸的反应并验证各种反应产物:

这些装置的连接顺序(按产物气.流从左至右的方向)是(填装置的编号):
___→___→___→___→___→___
(3)保险粉(Na2S2O4)广泛用于印染行业和食品储存行业.可以将SO2通入草酸钠(Na2C2O4)和足量NaOH的混合溶液中制取保险粉.离子方程式为___
(4)工业尾气中的SO2可在铜的作用下催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2-2n)H2O=2nCuSO4+(2-2n)H2SO4每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为___g.
▼优质解答
答案和解析
(1)A.二氧化硫具有还原性,溴单质具有氧化性,二者发生氧化还原反应,SO2+Br2+2H2O=2HBr+H2SO4,体现了二氧化硫的还原性,故A错误;
B.二氧化硫水溶液中反应生成亚硫酸显示酸性,二氧化硫的漂白性具有选择性不能使石蕊试液褪色,故B错误;
C.SO2和Cl2混合通入品红溶液,二者按照1:1恰好反应生成硫酸和盐酸,SO2+Cl2+2H2O=2HCl+H2SO4,不能使品红溶液褪色,故C错误;
D.SO2通入BaCl2溶液中无明显现象,SO2和NH3或NO2混合通入该溶液中,氨气和二氧化硫发生反应生成亚硫酸铵,结合钡离子生成亚硫酸钡白色沉淀,二氧化氮具有氧化性能氧化二氧化硫为硫酸,硫酸根离子结合钡离子生成硫酸钡白色沉淀,故D正确;
故答案为:D;
(2)木炭粉与浓硫酸发生反应选择固液加热装置选择E,检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在选择D,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,再检验二氧化硫是否除净,选择装置ABA,最后检验二氧化碳,选择C,尾气有毒需进行尾气处理,这些装置的连接顺序(按产物气.流从左至右的方向)是EDABAC,
故答案为:EDABAC;
(3)将SO2通入草酸钠(Na2C2O4)和NaOH的混合溶液生成Na2S2O4,根据元素守恒可知产物还有碳酸钠和水,反应的离子方程式为2SO2+C2O42-+4OH-
S2O42-+2CO32-+2H2O,
故答案为:2SO2+C2O42-+4OH-
S2O42-+2CO32-+2H2O;
(4)在反应:2SO2+2n Cu+(n+1)O2+(2-2n) H2O=2n CuSO4+(2-2n) H2SO4 中,每摩尔二氧化硫失去2mol电子,而每摩尔氧气能得到4mol电子,所以1molSO2能还原0.5molO2,每吸收标准状况下11.2L即0.5mol SO2,被SO2还原的O2的质量为0.25mol×32g/mol=8g,
故答案为:8;
B.二氧化硫水溶液中反应生成亚硫酸显示酸性,二氧化硫的漂白性具有选择性不能使石蕊试液褪色,故B错误;
C.SO2和Cl2混合通入品红溶液,二者按照1:1恰好反应生成硫酸和盐酸,SO2+Cl2+2H2O=2HCl+H2SO4,不能使品红溶液褪色,故C错误;
D.SO2通入BaCl2溶液中无明显现象,SO2和NH3或NO2混合通入该溶液中,氨气和二氧化硫发生反应生成亚硫酸铵,结合钡离子生成亚硫酸钡白色沉淀,二氧化氮具有氧化性能氧化二氧化硫为硫酸,硫酸根离子结合钡离子生成硫酸钡白色沉淀,故D正确;
故答案为:D;
(2)木炭粉与浓硫酸发生反应选择固液加热装置选择E,检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在选择D,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,再检验二氧化硫是否除净,选择装置ABA,最后检验二氧化碳,选择C,尾气有毒需进行尾气处理,这些装置的连接顺序(按产物气.流从左至右的方向)是EDABAC,
故答案为:EDABAC;
(3)将SO2通入草酸钠(Na2C2O4)和NaOH的混合溶液生成Na2S2O4,根据元素守恒可知产物还有碳酸钠和水,反应的离子方程式为2SO2+C2O42-+4OH-
| ||
故答案为:2SO2+C2O42-+4OH-
| ||
(4)在反应:2SO2+2n Cu+(n+1)O2+(2-2n) H2O=2n CuSO4+(2-2n) H2SO4 中,每摩尔二氧化硫失去2mol电子,而每摩尔氧气能得到4mol电子,所以1molSO2能还原0.5molO2,每吸收标准状况下11.2L即0.5mol SO2,被SO2还原的O2的质量为0.25mol×32g/mol=8g,
故答案为:8;
看了二氧化硫常用作消毒剂和漂白剂,...的网友还看了以下:
有两快面积相同的小麦实验田,第一块使用原品种,第二块使用新品种,分别收获小麦9000㎏和15000㎏ 2020-03-30 …
设绝对值小于1的全体实数的集合为S,在S中定义一种运算*,使得a*b=(a+b)/(1+ab)求证 2020-04-05 …
肺炎双球菌有多种,其中一种叫R型细菌,菌体无多糖类荚膜,是无毒性的;另一种叫S型细菌,菌体有多糖类 2020-04-07 …
高二生物question自然界中生物种群增长常表现为“S”型增长曲线.下列有关种群“S”型增长的正 2020-07-21 …
有如下算法第一步使x=3,S=0第二步使x=x+2第三步使S=S+x第四步如果S>=2000,则执 2020-07-23 …
某人用同一水平力F先后两次拉同一物体,第一次使物体从静止开始在光滑水平面上前进S距离;第二次使物体从 2020-10-31 …
初等数论问题若a,b是任意二整数,且b不等于0,证明:存在两个整数s,使得a=bs+t,t的绝对值小 2020-11-17 …
下列对“某种物质”的叙述错误的是()A.格里菲斯认为加热杀死的S型肺炎双球菌中存在“某种物质”使R型 2020-12-07 …
第一步使x=3,S=0第二步使x=x+2第三步使S=S+x第四步如果S>=2000,则执行第五步,否 2020-12-09 …
平行四边形面积公式平行四边形面积有两种算法,一种是S=bc,另外一种是S=bcSinA(A为bc两边 2021-01-30 …