早教吧作业答案频道 -->化学-->
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:请回答下列问题:(1)由B2O3制备BF3、BN的化学方程式依次是、.(2)基
题目详情
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
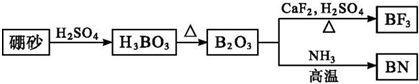
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是___、___.
(2)基态B原子的电子排布式为___;B和N相比,电负性较大的是___,BN中B元素的化合价为___.
(3)在BF3分子中,F-B-F的键角是___;B原子的杂化轨道类型为___,BF3与过量NaF作用可生成NaBF4,B的立体构型为___.
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有___个氮原子、___个硼原子,立方氮化硼的密度是___ g•cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是___、___.
(2)基态B原子的电子排布式为___;B和N相比,电负性较大的是___,BN中B元素的化合价为___.
(3)在BF3分子中,F-B-F的键角是___;B原子的杂化轨道类型为___,BF3与过量NaF作用可生成NaBF4,B的立体构型为___.
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有___个氮原子、___个硼原子,立方氮化硼的密度是___ g•cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA).
▼优质解答
答案和解析
(1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,方程式为B2O3+3CaF2+3H2SO4
2BF3↑+3CaSO4+3H2O;B2O3与氨气在高温下反应即生成BN,方程式为B2O3+2NH3
2BN+3H2O,
故答案为:B2O3+3CaF2+3H2SO4
2BF3↑+3CaSO4+3H2O;B2O3+2NH3
2BN+3H2O;
(2)基态B原子的电子排布式为1s22s2sp1;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3.故答案为:1s22s2sp1;N;+3;
(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数=
×(a-xb)=
×(3-3×1)=0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4-中心原子的孤对电子对数=
×(a-xb)=
×(4-4×1)=0,其价层电子对数为4,所以其结构为正四面体.故答案为:120°;sp2;正四面体;
(4)根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8×
+6×
+4=8,因此一个立方氮化硼晶胞中含有4个N原子和4个B原子.一个晶胞中的质量为
,一个立方氮化硼晶胞的体积是(361.5pm)3,因此立方氮化硼的密度
是 g•pm-3.
故答案为:4;4;
.
| ||
| ||
故答案为:B2O3+3CaF2+3H2SO4
| ||
| ||
(2)基态B原子的电子排布式为1s22s2sp1;B与N 均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3.故答案为:1s22s2sp1;N;+3;
(3)依据价层电子对互斥理论,计算出BF3的孤对电子对数=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(4)根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 25g |
| NA |
| 25×4 |
| (361.5)3NA |
故答案为:4;4;
| 25×4 |
| (361.5)3NA |
看了 氮化硼(BN)是一种重要的功...的网友还看了以下:
阅读材料,结合所学知识回答问题材料一11世纪中期,印刷技术出现了重大突破,平民毕昇经过反复实验,发 2020-06-16 …
阅读材料回答下列问题。材料一1640年,英国掀开了资产阶级革命的序幕,……几年以后,经过反复斗争, 2020-07-13 …
阅读下面材料,完成下列各题。材料一经典反复地重译是没有必要的。经典是一种常销书,以《国富论》为例, 2020-07-21 …
“公民们,拿起武器来!现在的问题是胜利还是陷入凡尔赛反动分子和教士们的毒手,这些穷凶极恶的家伙已经拿 2020-11-13 …
英语翻译本文以间苯二甲酸为原料经硝化、还原和重氮化-偶联反应合成标题化合物,并对硝化、还原和重氮化- 2020-11-29 …
“一带一路”(丝绸之路经济带和21世纪海上丝绸之路)建设是新形势下我国对外开放的重大战略。阅读材料, 2020-11-30 …
表中材料反映了2009年大蒜价格变动的多方面经济关系,概括材料中体现的经济学道理。材料经济学道理示例 2020-12-14 …
读长江水系图及相关资料,回答下列问题.(1)图中资料2反映的问题是.该问题产生的原因是.(2)图中资 2020-12-25 …
为什么有的材料作文题给的材料是正反两方面的?如果遇到这种材料题、是从正反两方面任意一方面写吗?如下阅 2021-01-17 …
制取氢氧化钠以贝壳(主要成分是碳酸钙)、水和纯碱为原料,经过反应可制得氢氧化钠.请写出有关反应的化学 2021-02-01 …