早教吧作业答案频道 -->化学-->
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4.①写出CO2与H2反应生成CH4和H2O的热化学方程式.已知:CO(g)+
题目详情
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4.
①写出CO2与H2反应生成CH4和H2O的热化学方程式___.
已知:
CO(g)+H2O(g)⇌H2(g)+CO2(g)△H1=-41kJ•mol-1
C(s)+2H2(g)⇌CH4(g)△H2=-73kJ•mol-1 2CO(g)⇌C(s)+CO2(g)△H3=-171kJ•mol-1
②科学家用氮化镓材料与铜组装如图的人工光合系统: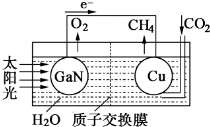 ,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___.为提高该人工光合系统的工作效率,可向装置中加入少量___(填“盐酸”或“硫酸”).
,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___.为提高该人工光合系统的工作效率,可向装置中加入少量___(填“盐酸”或“硫酸”).
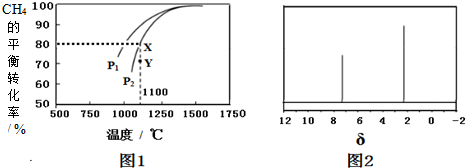
(2)天然气制取H2的原理为:CO2(g)+CH4(g)═2CO(g)+2H2(g).在密闭容器中通入浓度均为0.125mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图1所示,则压强P1___P2(填“>”或“<”);压强为P2时,在Y点:v(正)___v(逆)(填“>”、“<”或“=”);求温度为1100℃,压强为P2时该反应的平衡常数K=___(计算结果保留三位有效数字).
(3)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如上图2,则X的结构简式为___.(相对原子量:C-12 H-1)
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4.
①写出CO2与H2反应生成CH4和H2O的热化学方程式___.
已知:
CO(g)+H2O(g)⇌H2(g)+CO2(g)△H1=-41kJ•mol-1
C(s)+2H2(g)⇌CH4(g)△H2=-73kJ•mol-1 2CO(g)⇌C(s)+CO2(g)△H3=-171kJ•mol-1
②科学家用氮化镓材料与铜组装如图的人工光合系统:
 ,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___.为提高该人工光合系统的工作效率,可向装置中加入少量___(填“盐酸”或“硫酸”).
,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式___.为提高该人工光合系统的工作效率,可向装置中加入少量___(填“盐酸”或“硫酸”).
(2)天然气制取H2的原理为:CO2(g)+CH4(g)═2CO(g)+2H2(g).在密闭容器中通入浓度均为0.125mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图1所示,则压强P1___P2(填“>”或“<”);压强为P2时,在Y点:v(正)___v(逆)(填“>”、“<”或“=”);求温度为1100℃,压强为P2时该反应的平衡常数K=___(计算结果保留三位有效数字).
(3)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如上图2,则X的结构简式为___.(相对原子量:C-12 H-1)
▼优质解答
答案和解析
(1)①已知:Ⅰ.CO(g)+H2O(g)⇌H2(g)+CO2(g)△H1=-41kJ•mol-1
Ⅱ.C(s)+2H2(g)⇌CH4(g)△H2=-73kJ•mol-1
Ⅲ.2CO(g)⇌C(s)+CO2(g)△H3=-171kJ•mol-1
根据盖斯定律,Ⅲ-Ⅰ×2+Ⅱ可得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1;
②由电池装置图可知,Cu电极上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O,可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸,
故答案为:CO2+8e-+8H+=CH4+2H2O;硫酸;
(2)温度一定时,增大压强平衡逆向移动,甲烷的转化率减小,故压强P12;
Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡,则v(正)>v(逆;
温度为1100℃,压强为P2时甲烷的转化率为80%,则平衡时甲烷浓度变化量为0.125mol•L-1×80%=0.1mol,则:
CO2(g)+CH4(g)═2CO(g)+2H2(g)
起始浓度(mol/L):0.125 0.125 0 0
变化浓度(mol/L):0.1 0.1 0.2 0.2
平衡浓度(mol/L):0.025 0.025 0.2 0.2
故平衡常数K=
=
(mol.L)2=2.56 mol2•L-2,
故答案为:<;>2.56 mol2•L-2;
(3)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由
=8…10,可知分子式为C8H10,分子中含有一个苯环,为苯的同系物,核磁共振氢谱中有2个峰,可知分子中含有2种环境的H,应含有2个甲基且处于对位位置,则X的结构简式为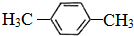 ,
,
故答案为: .
.
Ⅱ.C(s)+2H2(g)⇌CH4(g)△H2=-73kJ•mol-1
Ⅲ.2CO(g)⇌C(s)+CO2(g)△H3=-171kJ•mol-1
根据盖斯定律,Ⅲ-Ⅰ×2+Ⅱ可得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1;
②由电池装置图可知,Cu电极上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O,可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸,
故答案为:CO2+8e-+8H+=CH4+2H2O;硫酸;
(2)温度一定时,增大压强平衡逆向移动,甲烷的转化率减小,故压强P1
Y点甲烷转化率小于同温同压下平衡时转化率,故Y点向正反应进行建立平衡,则v(正)>v(逆;
温度为1100℃,压强为P2时甲烷的转化率为80%,则平衡时甲烷浓度变化量为0.125mol•L-1×80%=0.1mol,则:
CO2(g)+CH4(g)═2CO(g)+2H2(g)
起始浓度(mol/L):0.125 0.125 0 0
变化浓度(mol/L):0.1 0.1 0.2 0.2
平衡浓度(mol/L):0.025 0.025 0.2 0.2
故平衡常数K=
| c2(CO)×c2(H2) |
| c(CO2)×c(CH4) |
| 0.22×0.22 |
| 0.025×0.025 |
故答案为:<;>2.56 mol2•L-2;
(3)芳香烃X的相对分子质量为l06,设其分子式为CxHy,由
| 106 |
| 12 |
 ,
,故答案为:
 .
.
看了天然气是一种重要的清洁能源和化...的网友还看了以下:
下列叙述正确的是()A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心B.CH2 2020-04-11 …
研究氮及其化合物对化工生产有重要意义.(1)工业合成氨的原理为N2(g)+3H2(g)⇌2NH3( 2020-05-13 …
两个H原子结合生成氢气放出能量7.23*10^-19J每个H原子的质量是1.67*10^-27kg 2020-05-23 …
有人建议把H元素排在元素周期表的7主族.下列事实能支持这观点的是1.H原子得到一个电子就可以达到稳 2020-05-24 …
丁醇是重要的化工原料,可以制备抗氧剂F等.其工业合成路线如下,其中A是分子中有4种化学环境不同H原 2020-06-16 …
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:合成氨是人类研究的重要课题,目前工业 2020-07-20 …
有机物H是一种重要的化工原料,其合成工艺如图所示:已知:①②C的质谱图中最大质荷比为72,其核磁共 2020-07-29 …
化学反应原理这本书中,有条式子△H=H(生成物)-H(反应物)*H是指焓,还有条式子说△H=Q=生成 2020-11-07 …
3、某分部工程有A、B、C、D、E、F、G、H八道工序,其逻辑关系是:A完成后进行E、F.E完成后进 2020-12-01 …
C原子是什么时候形成的宇宙大爆炸初期形成了H原子,随后产生了He和Li原子..C原子是在什么时候形成 2021-02-05 …