早教吧作业答案频道 -->化学-->
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.(1)SO2在烟尘的催化下形成硫酸的反应方程式是
题目详情
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)SO2在烟尘的催化下形成硫酸的反应方程式是___.
(2)已知2SO2 (g)+O2 (g)⇌2SO3(g)△H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在2L容积固定不变的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=___.
②在①的条件下,判断该反应达到平衡状态的标志是___(填字母).
a.SO2、O2、SO3三者的浓度之比为2:1:2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2 的生成速率和SO3的生成速率相等
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)
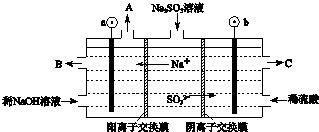
①图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___.
②SO32-放电的电极反应式为___.
③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为___g(假设该过程中所有液体进出口密闭).
(1)SO2在烟尘的催化下形成硫酸的反应方程式是___.
(2)已知2SO2 (g)+O2 (g)⇌2SO3(g)△H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在2L容积固定不变的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=___.
②在①的条件下,判断该反应达到平衡状态的标志是___(填字母).
a.SO2、O2、SO3三者的浓度之比为2:1:2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2 的生成速率和SO3的生成速率相等
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)

①图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___.
②SO32-放电的电极反应式为___.
③电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为___g(假设该过程中所有液体进出口密闭).
▼优质解答
答案和解析
(1)SO2在烟尘的催化下形成硫酸是2SO2+2H2O+O2=2H2SO4,
故答案为:2SO2+2H2O+O2=2H2SO4;
(2)①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,
2SO2(g)+O2⇌2SO3(g)△H<0
起始量(mol) 2.0 1.0 0
变化量(mol)2.0×50% 0.5 0.5
平衡量(mol) 1.0 0.5 0.5
前5min内O2的平均反应速率=
=0.05mol/(L•min);
故答案为:0.05mol/(L•min);
②化学平衡的标志是正逆反应速率相同,各组分含量保持不变;
a.物质的浓度关系和起始量和转化率有关,SO2、O2、SO3三者的浓度之比为2:1:2 不能说明反应达到平衡状态,故a不符合;
b.因为该反应为气体物质的量增大的反应,恒温恒容条件下,压强为变量,当容器中气体的压强不变说明达到平衡状态,故b符合;
c.反应前后气体质量不变,容器体积不变,密度在反应过程中和平衡状态都不变,容器中混合气体的密度保持不变不能说明费用达到平衡状态,故c不符合;
d.SO3的物质的量不再变化,能说明反应达到平衡状态,故d符合;
e.SO2的生成速率和SO3的生成速率相等说明正逆反应速率相同,能说明反应达到平衡状态,故e符合;
故答案为:bde;
(3)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,
故答案为:负;硫酸;
②SO32-失去电子被氧化成SO42-,电极反应式为:SO32--2e-+H2O=SO42-+2H+,
故答案为:SO32--2e-+H2O=SO42-+2H+;
③电解过程中阴极区放氢生碱,水变为氢氧化钠,阴极区变化的质量等于氢氧化钠的质量减去消耗水的质量;
根据电子守恒:
2e-~Na2SO3,~2H2O~2NaOH~阴极区变化的质量
126g 36g 80g 44g
12.6g x
x=4.4g
若消耗12.6g Na2SO3,则阴极区变化的质量为4.4 g,
故答案为:4.4.
故答案为:2SO2+2H2O+O2=2H2SO4;
(2)①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,
2SO2(g)+O2⇌2SO3(g)△H<0
起始量(mol) 2.0 1.0 0
变化量(mol)2.0×50% 0.5 0.5
平衡量(mol) 1.0 0.5 0.5
前5min内O2的平均反应速率=
| 0.5mol |
| 2L×5min |
故答案为:0.05mol/(L•min);
②化学平衡的标志是正逆反应速率相同,各组分含量保持不变;
a.物质的浓度关系和起始量和转化率有关,SO2、O2、SO3三者的浓度之比为2:1:2 不能说明反应达到平衡状态,故a不符合;
b.因为该反应为气体物质的量增大的反应,恒温恒容条件下,压强为变量,当容器中气体的压强不变说明达到平衡状态,故b符合;
c.反应前后气体质量不变,容器体积不变,密度在反应过程中和平衡状态都不变,容器中混合气体的密度保持不变不能说明费用达到平衡状态,故c不符合;
d.SO3的物质的量不再变化,能说明反应达到平衡状态,故d符合;
e.SO2的生成速率和SO3的生成速率相等说明正逆反应速率相同,能说明反应达到平衡状态,故e符合;
故答案为:bde;
(3)①根据电解池中阴阳离子的移动方向:阳离子移向阴极可以判断①图中a极要连接电源的负极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4,
故答案为:负;硫酸;
②SO32-失去电子被氧化成SO42-,电极反应式为:SO32--2e-+H2O=SO42-+2H+,
故答案为:SO32--2e-+H2O=SO42-+2H+;
③电解过程中阴极区放氢生碱,水变为氢氧化钠,阴极区变化的质量等于氢氧化钠的质量减去消耗水的质量;
根据电子守恒:
2e-~Na2SO3,~2H2O~2NaOH~阴极区变化的质量
126g 36g 80g 44g
12.6g x
x=4.4g
若消耗12.6g Na2SO3,则阴极区变化的质量为4.4 g,
故答案为:4.4.
看了 工业废气、汽车尾气排放出的S...的网友还看了以下:
如图所示,两个相切的圆表示一个静止的原子核发生某种衰变后,释放出来的粒子和反冲核在磁场中运动的轨迹 2020-04-05 …
关于射线探测及放射性的应用,下列说法正确的是()A.α粒子在威尔逊云室的径迹直而粗,是因为α粒子的 2020-05-14 …
塑料造粒 本人想买一台PP塑料造粒机 主要是废编织袋造粒请问买双杆的还是买单干的啊PP 和PET 2020-05-16 …
一个量筒,盛有400ml的水,放入5粒大小相同的钢珠后,水面显示的刻度是490ml.每粒钢珠钢珠的 2020-05-24 …
(2014•连云港二模)如图是带电粒子在气泡室中运动径迹的照片及其中某条径迹的放大图.匀强磁场与带 2020-06-27 …
如图所示,金属板A与B平行且相距为d,在A板上放置一小粒放射性物质钴60,它不断释放α粒子,这些粒 2020-07-10 …
有两袋糖,一袋是八十四粒,一袋是二十粒.每次从多的一袋里取出八粒放到少的一袋里去,取几次才能使两袋糖 2020-10-30 …
一个自行车轮胎,放在前轮行2500千米报废,放在后轮行1500千米报废,若行驶一段时间后将前后两个轮 2020-11-03 …
在循环经济的理念里,没有“废弃物”这一概念,所有废弃物都是“放错地方的资源”。这告诉我们①“废弃物” 2020-11-05 …
节约资源和保护环境与我们息息相关,下列日常行为做法正确的是()A.废旧电池放在图中的A箱中B.废旧铁 2020-11-08 …