早教吧作业答案频道 -->化学-->
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:请回答下列问题:(1)由B2O3制备BN的化学方程式是;(2)B和N相比,电负性
题目详情
氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示:
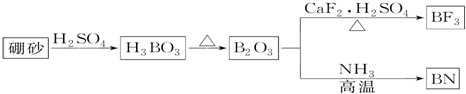
请回答下列问题:
(1)由B2O3制备BN的化学方程式是___;
(2)B和N相比,电负性较大的是___,BN中B元素的化合价为___;
(3)在BF3分子中,F-B-F的键角是___,B原子的杂化轨道类型为___;
(4)BF3和过量NaF作用可生成NaBF4,BF
的立体构型为___;
(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为___,N原子L层的P电子比S电子多___个.
(6)写出CaF2的电子式:___.

请回答下列问题:
(1)由B2O3制备BN的化学方程式是___;
(2)B和N相比,电负性较大的是___,BN中B元素的化合价为___;
(3)在BF3分子中,F-B-F的键角是___,B原子的杂化轨道类型为___;
(4)BF3和过量NaF作用可生成NaBF4,BF
| - 4 |
(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为___,N原子L层的P电子比S电子多___个.
(6)写出CaF2的电子式:___.
▼优质解答
答案和解析
解(1)由工艺流程可知,B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成,反应方程式为:B2O3+2NH3
2BN+3H2O,
故答案为:B2O3+2NH3
2BN+3H2O;
(2)同周期从左到右电负性依次增强,所以电负性N>B;B第ⅢA族元素,为+3价;
故答案为:N;+3;
(3)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=
(a-xb)=
(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3分子的中心原子B原子的价层电子对数为;3,属于sp2杂化,
故答案为:120°;sp2杂化;
(4)BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+
=4,该离子中不含孤电子对,为正四面体结构,故答案为:正四面体;
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,氮原子的外围电子排布为1s22s22p3;所以N原子L层的P电子比S电子多4-3=1,故答案为:共价键;1;
(6)氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边,氟化钙的电子式为: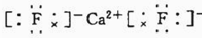 ,故答案为:
,故答案为: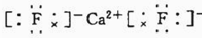 .
.
| ||
故答案为:B2O3+2NH3
| ||
(2)同周期从左到右电负性依次增强,所以电负性N>B;B第ⅢA族元素,为+3价;
故答案为:N;+3;
(3)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:120°;sp2杂化;
(4)BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+
| 1 |
| 2 |
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,氮原子的外围电子排布为1s22s22p3;所以N原子L层的P电子比S电子多4-3=1,故答案为:共价键;1;
(6)氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边,氟化钙的电子式为:
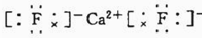 ,故答案为:
,故答案为: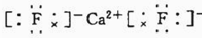 .
.
看了 氮化硼(BN)是一种重要的功...的网友还看了以下:
海轮途经30°S,82°W,该地的对跖点经纬度是()A.60°N,98°EB.30°N,98°EC 2020-05-13 …
养水草的底砂(红陶砂)把水弄得非常浑,请教是怎么回事?缸是开好的,硝化菌已培养成熟,原本裸缸养鱼, 2020-05-16 …
砂带目数的意思比如:60目砂带.颗粒的直径是多少?砂带颗粒的材质?颗粒是怎么选出来的?采用的什么的 2020-05-17 …
1)2.5克某铜矿中涵氧化铜0.5克,则此铜矿中含铜的百分含量是——A.16%B.20%C.25. 2020-05-23 …
紫光炼铜厂购进一批铜矿砂,按照合同规定,矿砂中氧化铜的质量分数不得低于90%.商品检验局从矿砂中取 2020-05-23 …
丰子恺《竹影》中“这叫做‘朱竹’,是用笔蘸了朱砂来撇的.”中“蘸”读“zhàn”还是“zhan”? 2020-06-06 …
我国晋代炼丹家、医学家葛洪所著《抱扑子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”,其中丹砂是 2020-06-22 …
硼酸砂是什么我确定有硼酸砂这种物质的,不信你可以百度查一查,不过,我查不到它的化学式.我做实验需要 2020-06-29 …
将辰砂(经测定不含铁元素)和铁粉的混合物加热,生成了汞和硫化亚铁(FeS),则辰砂是由(填元素符号 2020-07-08 …
关于不等式的```石英砂是玻璃等工业的重要原料,某石英砂厂有一线生产工人200名,原来都参加将石英 2020-07-15 …