早教吧作业答案频道 -->化学-->
在弱电解质溶液中存在电离平衡,试回答下列问题.(1)氨水是中学常见的弱碱①常温下,下列事实不能证明氨水是弱碱的是(填字母序号).A.氨水能跟稀盐酸反应生成氯化铵B.P
题目详情
在弱电解质溶液中存在电离平衡,试回答下列问题.
(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是___(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是___(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
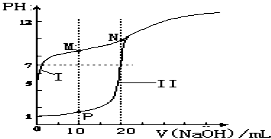
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)___.
②下列说法不正确的是___(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m___n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
以下离子浓度关系的判断正确的是___
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)

(1)氨水是中学常见的弱碱
①常温下,下列事实不能证明氨水是弱碱的是___(填字母序号).
A.氨水能跟稀盐酸反应生成氯化铵
B. PH=11的氨水稀释10倍后,溶液的PH>10
C.0.1mol•L-1氨水pH为11
D.0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是___(填字母序号).
A.通入氨气 B.加入少量氯化铝固体 C.加水稀释 D.加入少量氯化铵固体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
①N点pH>7的原因是(用离子方程式表示)___.
②下列说法不正确的是___(填字母).
a.M点c(Na+)>c(X-) b.M点c(HX)<c(X-)
c.M点 c(HX)+c(X-)=2c(Na+)d.N点c(H+)+c(HX)=c(OH-)
(3)若将pH=11、等体积的NaOH溶液和NH3•H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH=9,则m___n(填“<”“>”或“=”).
(4)常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.NaHSO3溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)=c(HSO3-)+2c(SO32-)
▼优质解答
答案和解析
(1)①A.氨水和稀盐酸反应生成氯化铵,说明一水合氨是碱,但不能说明一水合氨部分电离,所以不能说明是弱电解质,故A错误;
B. PH=11的氨水稀释10倍后,溶液的PH>10,证明溶液中一水合氨存在电离平衡,能说明是弱电解质,故B正确;
C.常温下,0.1mol•L-1氨水pH为11,溶液呈碱性,说明一水合氨部分电离,则说明一水合氨是弱电解质,故C正确;
D.常温下,0.1mol/L的氯化铵溶液pH约为5,溶液呈酸性,说明氯化铵是强酸弱碱盐,则说明一水合氨是弱电解质,故D正确;
故答案为:A;
②A.通入氨气,氨水的浓度增大,电离程度减小,故A错误;
B.加入少量氯化铝固体,铝离子会消耗氢氧根离子,则促进一水合氨的电离,电离程度增大,故B正确;
C.加水稀释,促进一水合氨的电离,电离程度增大,故C正确;
D.加入少量氯化铵固体,铵根离子浓度增大,抑制氨水的电离,电离程度减小,故D错误;
故答案为:BC;
(2)0.1mol•L-1 HCl溶液,是强酸溶液完全电离,所以溶液的PH=1;而0.1mol•L-1 HX溶液的PH>5说明是弱酸部分电离,故答案为:弱;
①N点pH>7的原因是因为两者等物质的量恰好完全反应生成强碱弱酸盐溶液水解呈碱性,所以水解反应方程式为:X-+H2O⇌HX+OH-,
故答案为:X-+H2O⇌HX+OH-;
②a.M点生成等浓度的HX和NaX的混合溶液,溶液呈碱性,说明水解大于电离,而水解程度微弱,所以M点c(Na+)>c(X-),故a正确;
b.M点生成等浓度的HX和NaX的混合溶液,溶液呈碱性,说明水解大于电离,则M点c(HX)>c(X-),故b错误;c.M点生成等浓度的HX和NaX的混合溶液,溶液呈碱性,溶液中存在物料守恒,2n(Na)=n(X),M点 c(HX)+c(X-)=2c(Na+),故c正确;
d.N点是氢氧化钠和HX恰好完全反应生成的NaX溶液,溶液中存在质子守恒,c(H+)+c(HX)=c(OH-),故d正确;
故答案为:b;
(3)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(4)用Na2SO3溶液吸收SO2时,随着吸收的增多,溶液由碱性逐渐变为酸性,
A.由表中信息可知NaHSO3溶液为酸性溶液,溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3),故A正确;
B.Na2SO3溶液中SO32-的水解存在二级水解,亚硫酸氢根离子水解程度较小,且水电离也产生氢氧根离子,所以c(HSO3-)应小于c (OH-),溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故B错误;
C.由表中数据,当c (SO32-)=c (HSO3-)时,pH=7.2,故当吸收液呈中性时,可推出c (SO32-)3-),故C错误;
D.因c(H+)=c (OH-),根据电荷守恒,c(H+)+c(Na+)=c (HSO3-)+2c (SO32-)+c (OH-),c(Na+)=c (HSO3-)+2c (SO32-)成立,故D正确,
故答案为:AD.
B. PH=11的氨水稀释10倍后,溶液的PH>10,证明溶液中一水合氨存在电离平衡,能说明是弱电解质,故B正确;
C.常温下,0.1mol•L-1氨水pH为11,溶液呈碱性,说明一水合氨部分电离,则说明一水合氨是弱电解质,故C正确;
D.常温下,0.1mol/L的氯化铵溶液pH约为5,溶液呈酸性,说明氯化铵是强酸弱碱盐,则说明一水合氨是弱电解质,故D正确;
故答案为:A;
②A.通入氨气,氨水的浓度增大,电离程度减小,故A错误;
B.加入少量氯化铝固体,铝离子会消耗氢氧根离子,则促进一水合氨的电离,电离程度增大,故B正确;
C.加水稀释,促进一水合氨的电离,电离程度增大,故C正确;
D.加入少量氯化铵固体,铵根离子浓度增大,抑制氨水的电离,电离程度减小,故D错误;
故答案为:BC;
(2)0.1mol•L-1 HCl溶液,是强酸溶液完全电离,所以溶液的PH=1;而0.1mol•L-1 HX溶液的PH>5说明是弱酸部分电离,故答案为:弱;
①N点pH>7的原因是因为两者等物质的量恰好完全反应生成强碱弱酸盐溶液水解呈碱性,所以水解反应方程式为:X-+H2O⇌HX+OH-,
故答案为:X-+H2O⇌HX+OH-;
②a.M点生成等浓度的HX和NaX的混合溶液,溶液呈碱性,说明水解大于电离,而水解程度微弱,所以M点c(Na+)>c(X-),故a正确;
b.M点生成等浓度的HX和NaX的混合溶液,溶液呈碱性,说明水解大于电离,则M点c(HX)>c(X-),故b错误;c.M点生成等浓度的HX和NaX的混合溶液,溶液呈碱性,溶液中存在物料守恒,2n(Na)=n(X),M点 c(HX)+c(X-)=2c(Na+),故c正确;
d.N点是氢氧化钠和HX恰好完全反应生成的NaX溶液,溶液中存在质子守恒,c(H+)+c(HX)=c(OH-),故d正确;
故答案为:b;
(3)氨水为弱电解质,不能完全电离,如稀释相等体积,氨水溶液pH大,如稀释后溶液pH相同,则氨水应加入较多水,
故答案为:<;
(4)用Na2SO3溶液吸收SO2时,随着吸收的增多,溶液由碱性逐渐变为酸性,
A.由表中信息可知NaHSO3溶液为酸性溶液,溶液中c(HSO3-)>c(H+)>c(SO32-)>c(H2SO3),故A正确;
B.Na2SO3溶液中SO32-的水解存在二级水解,亚硫酸氢根离子水解程度较小,且水电离也产生氢氧根离子,所以c(HSO3-)应小于c (OH-),溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故B错误;
C.由表中数据,当c (SO32-)=c (HSO3-)时,pH=7.2,故当吸收液呈中性时,可推出c (SO32-)
D.因c(H+)=c (OH-),根据电荷守恒,c(H+)+c(Na+)=c (HSO3-)+2c (SO32-)+c (OH-),c(Na+)=c (HSO3-)+2c (SO32-)成立,故D正确,
故答案为:AD.
看了在弱电解质溶液中存在电离平衡,...的网友还看了以下:
张勇和高民两位同学在课外做中和反应探究实验.(1)他们用一种黄花汁作为酸碱指示剂滴入一些液体中,实 2020-05-14 …
张勇和高民两位同学在课外做中和反应探究实验.(1)他们用一种黄花汁作为酸碱指示剂滴入一些液体中,实 2020-05-14 …
小食品是同学们喜爱的食品之一,其实在小食品内包含很多化学原理.请选择以下物质填空(能填化学式的要填 2020-05-14 …
硫酸有以下性质和特性:①酸的通性,②吸水性,③脱水性,④强氧化性等,将下列实验现象硫酸表现出的性质 2020-06-26 …
7.关于土方的填筑与压实,下列说法正确的是().A.填土应从最低处开始分层进行B7.关于土方的填筑 2020-07-09 …
蛋白质的性质在生活中有许多实际应用.请在下表“性质”一栏中用“盐析”、“变性”或“颜色反应”表述的蛋 2020-11-02 …
蛋白质的性质在生活中有许多实际应用.请在下表“性质”一栏中用“盐析”、“变性”或“颜色反应”表述的蛋 2020-11-02 …
测定二氧化碳吸收传质系数实验填料吸收塔当提高喷淋量时对x2y2有何...测定二氧化碳吸收传质系数实验 2020-11-05 …
我们在初中化学里学过的一些物质,在实际生活中有重要的用途.现有以下物质在“A水、B石灰石、C生石灰、 2021-02-19 …
我们在初中化学里学过的一些物质,在实际生活中有重要的用途.现有以下物质在“A水、B碘酒、C二氧化碳、 2021-02-19 …