早教吧作业答案频道 -->化学-->
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.实验
题目详情
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.
实验测得数据和有关结果如下:
①准确称得无水硫酸铜 2.4g;
②测出量筒中水的体积,折算成标准状态下气体的体积为112mL;
③干燥管在实验后质量增加1.28g;
④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质).
请回答下列问题:
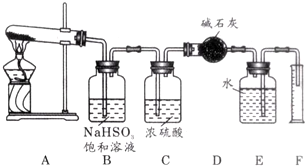
(1)装置B的作用是___;发生的化学方程式___.
(2)装置C的作用是___;干燥管收集到的物质是___.
(3)实验数据测出后,计算出氧气的物质的量有___mol;并据此计算出SO2为___mol,SO3为___mol.
实验测得数据和有关结果如下:
①准确称得无水硫酸铜 2.4g;
②测出量筒中水的体积,折算成标准状态下气体的体积为112mL;
③干燥管在实验后质量增加1.28g;
④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质).
请回答下列问题:

(1)装置B的作用是___;发生的化学方程式___.
(2)装置C的作用是___;干燥管收集到的物质是___.
(3)实验数据测出后,计算出氧气的物质的量有___mol;并据此计算出SO2为___mol,SO3为___mol.
▼优质解答
答案和解析
(1)混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2:SO3+2NaHSO3=Na2SO4+H2O+2SO2↑,可NaHSO3来除去三氧化硫,
故答案为:吸收生成的SO3气体;SO3+2NaHSO3=Na2SO4+H2O+2SO2↑;
(2)浓硫酸可作干燥剂,可吸收SO2和O2中的水蒸气;
SO2能与碱石灰反应,而氧气与与碱石灰不反应,所以干燥管收集到的物质是SO2,
故答案为:干燥SO2和O2;SO2;
(3)量筒内液体的体积即为O2的体积,其物质的量为:
=0.005mol,根据电子得失守恒n(O2)×4=n(SO2)×2,即0.005mol×4=n(SO2)×2,则n(SO2)=0.01mol,干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的)为1.28g,物质的量为0.02mol,所以与NaHSO3反应生成的SO2为0.01mol,由方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑可知SO3的物质的量为0.005mol,
故答案为:0.005;0.01;0.005.
故答案为:吸收生成的SO3气体;SO3+2NaHSO3=Na2SO4+H2O+2SO2↑;
(2)浓硫酸可作干燥剂,可吸收SO2和O2中的水蒸气;
SO2能与碱石灰反应,而氧气与与碱石灰不反应,所以干燥管收集到的物质是SO2,
故答案为:干燥SO2和O2;SO2;
(3)量筒内液体的体积即为O2的体积,其物质的量为:
| 0.112L |
| 22.4L/mol |
故答案为:0.005;0.01;0.005.
看了已知硫酸铜在加热条件下发生分解...的网友还看了以下:
实验室用滴定管测定未知的烧碱溶液.用100ML0.200mol/L硫酸,定容时,待容量瓶中溶液的凹 2020-04-12 …
测酸奶滴定酸度测定酸奶滴定酸度用除去其中的脂肪么 2020-05-17 …
(2006•佛山)为测定H2SO4与NaOH发生中和反应时敞出的热量,在右图的小烧杯中装入一定量的 2020-06-26 …
用标准盐酸滴定碳酸钠,求碳酸钠浓度.用已知浓度的盐酸来测定某碳酸钠溶液的浓度,若配制碳酸钠溶液时所 2020-06-27 …
质监局人员监测市场出售的老陈醋的酸度(国家规定食醋中总酸量3.5g/100mL~5g/100mL) 2020-07-12 …
关于钼锑抗分光光度法测定磷酸盐含磷量?请教一下采用钼锑搞分光光度法的磷酸盐测定方法原理及测定步骤,1 2020-11-01 …
黄铜(铜锌合金)是重要的金属材料.为测定黄铜材料中锌的含量,化学研究小组进行了实验:称取15.0g此 2020-11-01 …
质监局人员监测市场出售的老陈醋的酸度(国家规定食醋中总酸量3.5g/100mL~5g/100mL), 2020-11-11 …
(2009•泰州模拟)滴定法是科研和生产中测定溶液中物质浓度的常用方法.(1)莫尔法是一种沉淀滴定法 2020-11-12 …
测阿司匹林时为什么1mol乙酰水杨酸消耗2molNaOH,而不是3mol?采用反滴定法测定测阿司匹林 2020-12-22 …