实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到﹣3价.某同学取一定量的铁铝合金与一定量很稀的硝酸充分反
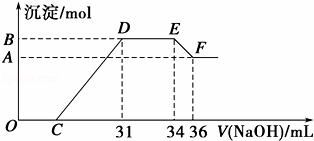
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,最低可以还原到﹣3价.某同学取一定量的铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L ﹣1 的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)请写出该合金中铁与硝酸反应的离子方程式 .
(2)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 .
(3)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 .
(4)B与A的差值为 mol.
(5)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL.
考点:
离子方程式的有关计算.
分析:
铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有: ①H++OH﹣=H2O, ②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓, ③NH4++OH﹣═NH3•H2O, ④Al(OH)3 +OH﹣=AlO2﹣+2H2O. (1)金属铁和稀硝酸反应生成硝酸铁、一氧化氮和水,据此回答; (2)O→C 之间没有沉淀生成,说明硝酸过量,O→C之间发生的反应酸碱中和反应; (3)D与E一段沉淀的量没有发生变化,为NH4NO3和NaOH反应; (4)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,利用发生的化学反应来计算; (5)沉淀的总量可根据NH4+的量,根据NH4++OH﹣═NH3•H2O 得出n(NH4+),根据氧化还原反应,N元素由+5价变为﹣3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量.
铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有: ①H++OH﹣=H2O, ②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓, ③NH4++OH﹣═NH3•H2O, ④Al(OH)3 +OH﹣=AlO2﹣+2H2O (1)根据图示得到的溶液和氢氧化钠反应产生沉淀的情况可以知道,金属铁和稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:8Fe+30H++3NO3﹣=8Fe3++3NH4++9H2O,故答案为:8Fe+30H++3NO3﹣=8Fe3++3NH4++9H2O; (2)OC之间没有沉淀生成,说明硝酸过量,OC之间发生的反应酸碱中和反应,离子方程式为H++OH﹣═H2O,故答案为:H++OH﹣═H2O; (3)DE一段沉淀的量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为NH4++OH﹣═NH3•H2O,故答案为:NH4++OH﹣═NH3•H2O; (4)由图可知,EF段消耗的氢氧化钠溶液为36mL﹣34m=2mL,故该计算参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH﹣=AlO2﹣+2H2O可知,Al(OH)3的物质的量为0.008mol,即为B、A的差值,故答案为:0.008; (5)图中OC段没有沉淀生成,此阶段发生的离子方程式为H++OH﹣=H2O;在DE段沉淀的物质的量没有变化,应为NH4+和OH﹣的反应,此阶段发生反应的离子方程式为NH4++OH﹣═NH3•H2O;根据NH4++OH﹣═NH3•H2O 得:n(NH4+)=(34﹣31)×10﹣3L×4mol/L=0.012 mol,根据氧化还原反应,N元素由+5价变为﹣3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量为:=0.032mol,所以生成沉淀的物质的量为0.032mol, 设Mg为xmol,Al为0.008mol,生成硝酸铵为(34﹣31)×0.001L×4mol/L=0.012mol, 由电子守恒可知,2x+0.008×3=0.012×8, 解得x=0.036mol, 滴加NaOH体积为31ml时, 发生反应为①H++OH﹣=H2O,②Mg2++2OH﹣=Mg(OH)2↓,Al3++3OH﹣=Al(OH)3↓, 则C点氢氧化钠溶液的体积为31mL﹣×1000mL﹣×1000L=7mL, 故答案为:0.032;7.
点评:
本题考查金属与硝酸的反应、氧化还原反应、化学计算等知识点,属于中等难度试题,解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用.
第一题:在一定条件下,NO和氨气可以发生反应生成氮气和水.现有NO和氨气的混合物共1mol,充分反应 2020-03-31 …
旷野对平原还可以对什么 2020-05-13 …
埃塞俄比亚全国大部分地区的气候类型是什么?高山高原气候还是热带草原气候?以及原因.还有埃塞俄比亚的 2020-05-14 …
很多人都听说过吴刚砍桂树的传说,因为吴刚砍树能力有限,所以无论吴刚怎么砍,桂树总是在当天夜里能还原 2020-06-19 …
Ag+不是没有孤对电子么,而配合物的形成原理不是中心原子提供孤对电子,而其他配位原子提供空轨道么. 2020-06-22 …
急积极照样子仿写句子(1)我以为吃的盐全是海水里提炼出来的,到了青海高原之后,才知道高原还有产盐的 2020-07-03 …
proe5.0制作的爆炸图还可以还原吗?如果可以,如何还原,还原到原来的装配位置. 2020-07-28 …
如图,将一支盛满CO2的试管倒立在一个装满水的水槽中观察到试管内;原因是.如果将水换成紫色石蕊试液, 2020-11-30 …
以下电算化会计岗位中,不能由主管会计兼任的是到底是电算主管还是电算系统管理员,请说明原因.可以由以下 2020-12-05 …
参考文献必须是使用了别人的原话吗?只是参考了著者的观点可以吗?还有就是参考文献的起讫页码怎么写?如果 2020-12-14 …