常温下0.1mol•L-1亚硫酸溶液中H2SO3、HSO3-、SO32-三者中所占物质的量分数(α)随pH变化的关系如图所示.下列表述正确的是()A.H2SO3⇌2H++SO32-K=10-5.2B.在0.1mol•LH2SO3溶液中
常温下 0.1mol•L-1 亚硫酸溶液中H2SO3、HSO3-、SO32- 三者中所占物质的量分数(α)随pH 变化的关系如图所示.下列表述 正确的是( )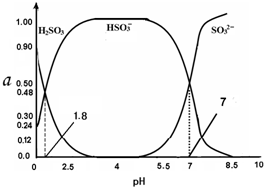
A. H2SO3⇌2H++SO32- K=10-5.2
B. 在0.1mol•L H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw
C. 在pH=2.5 溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D. 向pH 为 8.5 的上述体系中通入极少量 Cl2 的过程中,溶液中c(HSO3-)和c(SO32-)均减小
| 0.24×1 |
| 0.9 |
B.在0.10 mol•L-1 H2SO3溶液中,根据电荷守恒可得:c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),将电苻守恒式两边都乘c(H+)可得:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+c(H+)•c(OH-),Kw=c(H+)•c(OH-),所以c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw,故B正确;
C.在pH=2.5该溶液中,根据图象曲线可知c(HSO3-)>c(H2SO3),正确的离子浓度大小为:c(HSO3-)>c(H2SO3)>c(H+)>c(OH-),故C错误;
D.溶液的pH=8.5时显碱性,所以c(OH-)>c(H+),根据图象知,溶液中含有的是SO32-,SO32-在溶液中存在水解平衡:SO32-+H2O⇌HSO3-+OH-,向上述体系中通入极少量 Cl2,发生反应为:HSO3-+Cl2+H2O═SO42-+3H++2Cl-,促进SO32-水解,c(SO32-) 减小,而c(HSO3-)增大,故D错误;
故选B.
(2014•岳阳一模)水的离子积常数(KW)、电离常数(Ka、Kb)、溶度积常数(Ksp)等都是表 2020-04-12 …
用NA表示阿伏加德罗常数,下列叙述中正确的是()A.0.1mol•L-1稀硫酸100mL中含有硫酸 2020-05-13 …
可用质量分数表示吗我觉的不行单位都不一样但有一道化学题是多选两个选项分别是用两种形式表示溶液的量浓 2020-05-15 …
(2014•北海)海军迷小东想知道辽宁舰受到的浮力大小与哪些因素有关,他利用如图所示的装置进行探究 2020-06-12 …
用表示阿伏伽德罗常数,下列说法中正确的()A.1L1mol/L的醋酸溶液中离子总数为2NAB.0. 2020-06-18 …
NA表示阿伏伽德罗常数,下列叙述正确的是()A.1molFeI2与足量氯气反应时转移的电子数为2N 2020-06-18 …
在中国,酒的度数表示法,是指在温度为20℃的条件下,每100毫升酒液中所含酒精量的毫升数.蒸馏出来 2020-07-08 …
用NA表示阿伏伽德罗常数,下列叙述正确的是()A.64gSO2含有氧原子数为1NAB.物质的量浓度 2020-07-20 …
溶液的溶质质量分数是指溶液中溶质的质量与溶液质量的比值,常用百分数表示,常温下取下列固体各10g,分 2020-11-29 …
64个正数排成8行8列,如图所示:在符号aij(1≤i≤8,1≤j≤8)中,i表示该数所在行数,j表 2020-12-24 …