早教吧作业答案频道 -->化学-->
氮及其化合物在生产生活中有着重要作用.(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:T/K298398498
题目详情
氮及其化合物在生产生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
①试判断K2K1___(填写“>”“=”或“<”)②在298K时,下列各项能说明该反应已达到平衡状态的是___(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.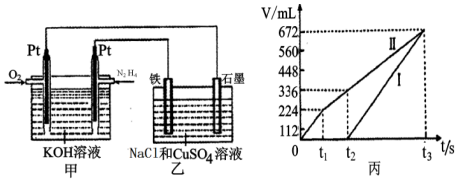
①该燃料电池的负极反应式为;___,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为___.③在t2时所得溶液的pH为___.(假设溶液体积不变,保留一位小数,lg2=0.3)
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g);△H<0,其平衡常数K与温度T的关系如表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2b.v(N2)=3v(H2)c.容器内压强保持不变d.混合气体的密度保持不变
(2)化合物N2H4做火箭发动机的燃料时,与氧化剂N2O4反应生成N2和水蒸气.某同学设计了一个N2H4--空气碱性燃料电池,并用该电池电解100mL-定浓度NaCl与CuSO4混合溶液,其装置如图所示.

①该燃料电池的负极反应式为;___,②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),原混合溶液中NaCl的物质的量浓度为___.③在t2时所得溶液的pH为___.(假设溶液体积不变,保留一位小数,lg2=0.3)
▼优质解答
答案和解析
(1)①N2(g)+3H2(g)⇌2NH3(g)△H<0为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K21,
故答案为:<;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故答案为:c;
(2)①肼燃料电池中,在碱性条件下,N2H4失电子生成氮气与水,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,
故答案为:N2H4+4OH--4e-=N2↑+4H2O;
②乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,生成氯气为224mL,由2Cl--2e-=Cl2↑可知,n(NaCl)=2n(Cl2)=
×2=0.02mol,所以c(NaCl)=
=0.2mol/L;
故答案为:0.2mol/L;
③t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=
=0.02mol,水电离出等物质的量的氢离子和氢氧根离子,所以n(H+)=0.02mol,c(H+)=
=0.2mol/L,所以溶液的pH=1-lg2=0.7,
故答案为:0.7.
故答案为:<;
③a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故答案为:c;
(2)①肼燃料电池中,在碱性条件下,N2H4失电子生成氮气与水,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,
故答案为:N2H4+4OH--4e-=N2↑+4H2O;
②乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,生成氯气为224mL,由2Cl--2e-=Cl2↑可知,n(NaCl)=2n(Cl2)=
| 0.224L |
| 22.4L/mol |
| 0.02mol |
| 0.1L |
故答案为:0.2mol/L;
③t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,t1~t2Ⅱ产生的气体体积=0.336L-0.224L=0.112L,阳极上生成112mL氧气需要n(OH-)=
| 0.112L×4 |
| 22.4L/mol |
| 0.02mol |
| 0.1L |
故答案为:0.7.
看了 氮及其化合物在生产生活中有着...的网友还看了以下:
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)在不同温度下,反应N2(g 2020-05-14 …
关于TFT-LCD常黑和常白的相关疑惑决定是常黑还是常白应该由两方面因素决定:1.液晶的初始扭转角 2020-05-16 …
常用于标定EDTA标准滴定溶液的基准物质有哪些?若使用纯金属为基准物质,在标定前应如何处理? 2020-05-17 …
施工承包合同规定,工程师的检查检验不应影响施工的正常进行,如影响施工正常进行,其处理原则是 2020-05-18 …
简述CTI_SERVER运行之后,“MEMState”可能显示的三种状态及其所代表的意义。若不正常, 2020-05-31 …
在库存系统中查询现存量与收发存汇总表统计数据不一致,而收发存汇总表中数据是正常的,应如何调整现存量, 2020-05-31 …
分析化学中,经常用Na2C2O4晶体作为基准物质测定高锰酸钾溶液的浓度,在硫酸溶液中,反应如下:请 2020-06-07 …
为什么在化学反应时,固体物质和纯液体物质的浓度可看作是一个固定的常数,比如加入纯水,可以将反应物稀 2020-07-22 …
微积分专家积分,是积而广之,是累积,是cumulative,只要曲线图形在x轴上方,只要起点固定,应 2020-11-13 …
当一个反应的化学平衡常数K大于10的五次方,则这个反应就可视为不可逆反应.如:1/2N2+3/2H2 2020-11-20 …