早教吧作业答案频道 -->化学-->
某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.实验(一)碘含量的测定取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘
题目详情
某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验(一) 碘含量的测定
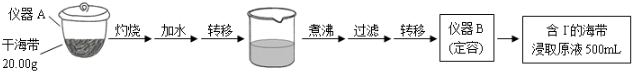
取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
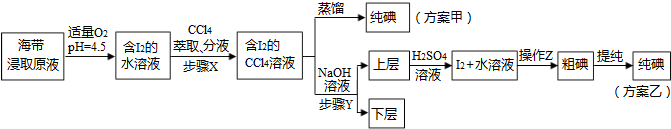
已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A___,仪器B___.
(2)①根据表中数据绘制滴定曲线:
②该次滴定终点时用去AgNO3溶液的体积为___mL,计算得海带中碘的百分含量为___%.
(3)①分液漏斗使用前须检漏,检漏方法为___.
②步骤X中,萃取后分液漏斗内观察到的现象是___.
③下列有关步骤Y的说法,正确的是___.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是___.
(4)方案甲中采用蒸馏不合理,理由是___.
实验(一) 碘含量的测定

取0.0100mol•L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E) 反映溶液中c(I-)的变化,部分数据如表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH═5NaI+NaIO3+3H2O
请回答:
(1)实验(一)中的仪器名称:仪器A___,仪器B___.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为___mL,计算得海带中碘的百分含量为___%.
(3)①分液漏斗使用前须检漏,检漏方法为___.
②步骤X中,萃取后分液漏斗内观察到的现象是___.
③下列有关步骤Y的说法,正确的是___.
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是___.
(4)方案甲中采用蒸馏不合理,理由是___.
▼优质解答
答案和解析
(1)根据仪器的构造可知,用于灼烧海带的仪器为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶,
故答案为:坩埚;500mL容量瓶;
(2)①根据表中数据可以绘制出电动势(E)与消耗硝酸银溶液体积的关系图为: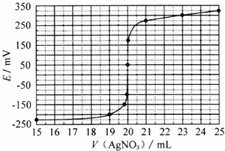 ,
,
故答案为: ;
;
②根据滴定曲线可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;
20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×
=0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:
×100%=0.635%,
故答案为:20.00mL;0.635%;
(3)①检查分液漏斗是否漏水的操作方法为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水,
故答案为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水;
②碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色,
故答案为:液体分为上下两层,下层呈紫红色;
③A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;
B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,故C错误;
D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;
故答案为:AB;
④步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成,故答案为:过滤;
(4)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理,故答案为:碘单质易升华,会导致碘损失.
故答案为:坩埚;500mL容量瓶;
(2)①根据表中数据可以绘制出电动势(E)与消耗硝酸银溶液体积的关系图为:
 ,
,故答案为:
 ;
;②根据滴定曲线可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;
20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×
| 500mL |
| 100mL |
| 127g/mol×0.001mol |
| 20.00g |
故答案为:20.00mL;0.635%;
(3)①检查分液漏斗是否漏水的操作方法为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水,
故答案为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水;
②碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色,
故答案为:液体分为上下两层,下层呈紫红色;
③A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;
B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,故C错误;
D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;
故答案为:AB;
④步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成,故答案为:过滤;
(4)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理,故答案为:碘单质易升华,会导致碘损失.
看了 某学习小组按如下实验流程探究...的网友还看了以下:
装订一批同样的练习本,原计划每本装16页,可以装订250本,如果要装订成200本,每本应装多少页? 2020-06-03 …
一种砖,给80平方米的地面铺要50块,给一间120平方米的教室铺要多少块装订一种练习本,装订20本 2020-06-06 …
比例尺缩放计算的问题.1原比例尺放大到n倍,放大以后的比例尺为:原比例尺Xn;原比例尺放大到n倍则 2020-07-10 …
已知数轴上有M和N两点.(1)若点M与原点O的距离为3,点N与原点O的距离为4,求M、N两点之间的 2020-07-30 …
复习数电有一句:基数为R,位数为n的原码N,其补码为(N)补=R^n-N,拿十进制举了例子,能看懂 2020-07-30 …
物理小组的同学们练习安装家庭电路,李明同学按图所示电路安装电路,闭合所有开关,发现灯均不亮,他做了如 2020-10-30 …
下列各项中注音有误的一项是()A、伺候cì装殓zhuāngliǎn装帧zhuāngzhēnB、卓见z 2020-11-06 …
下列各项中注音有误的一项是()A.伺候cì装殓zhuāngliǎn装帧zhuāngzhēnB.卓见z 2020-11-06 …
一道求n阶无穷小的题目e^(x^4-2x^2)-1,x->0时是x的n阶无穷小,求n(原题见于李永乐 2020-12-01 …
某商场进行童装特卖,凡特卖商品一率3折.有一套童装原价m元一个帽子原价n元,但营业员表只能打5折.小 2020-12-10 …