早教吧作业答案频道 -->化学-->
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.(1)若利用甲实验,可通过观察现象,
题目详情
H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.
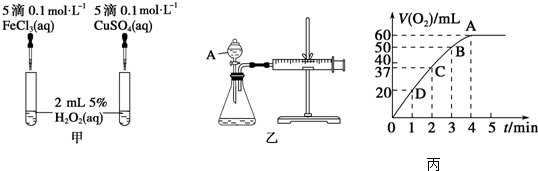
(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).223+2+3+2+22

324322
22222
-12-1-1

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置.

(1)若利用甲实验,可通过观察___现象,从而定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___,写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___,若利用乙实验可进行定量分析,图中仪器A的名称为___,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___.
(2)将0.1mol MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:___,H2O2初始物质的量浓度为___(保留两位有效数字).
(3)为了加深同学们对影响反应速率因素的认识,老师让同学完成如下实验:在上述实验装置的锥形瓶内加入6.5g锌粒,通过分液漏斗加入40mL 2.5mol•L-1的硫酸,10s时收集产生的H2的体积为44.8mL(标准状况),用硫酸表示10s内该反应的速率为___ mol•L-1•s-1(假设反应前后溶液的体积不变).223+2+3+2+22

324322
22222
-12-1-1
▼优质解答
答案和解析
(1)该反应中产生气体,可根据生成气泡的快慢判断,氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
2H2O+O2↑,A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间,
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H2O2
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间,
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H22O22
2H2O+O2↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑;分液漏斗;产生40mL气体所需的时间;
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H22O22完全反应放出60 mL O22,H22O22的分解反应为2H22O22
2H2O+O2↑,则n(H2O2)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
MnO2 MnO2 MnO2 MnO2 2 2H22O+O22↑,则n(H22O22)=
×2≈0.00536 mol,c(H2O2)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.06L 22.4L/mol 0.06L 0.06L 0.06L22.4L/mol 22.4L/mol 22.4L/mol×2≈0.00536 mol,c(H22O22)=
≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.00536mol 0.05L 0.00536mol 0.00536mol 0.00536mol0.05L 0.05L 0.05L≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H22SO44=ZnSO44+H22↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
=0.005mol•L-1•s-1,
故答案为:0.005.
0.002mol 0.04L×10s 0.002mol 0.002mol 0.002mol0.04L×10s 0.04L×10s 0.04L×10s=0.005mol•L-1-1•s-1-1,
故答案为:0.005.
| ||
故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H2O2
| ||
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;2H22O22
| ||
(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.(2)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H22O22
| ||
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.
| ||
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| ||
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
| MnO2 |
. |
.
.
.
.
.| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.06L |
| 22.4L/mol |
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.00536mol |
| 0.05L |
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L;
(3)Zn+H22SO44=ZnSO44+H22↑
1mol 22.4L
0.002mol 0.0448L
用硫酸表示10s内该反应的速率为v=
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
| 0.002mol |
| 0.04L×10s |
故答案为:0.005.
看了 H2O2不稳定、易分解,Fe...的网友还看了以下:
二(1)班同学参观科学馆,在门口排成一路纵队.女同学排在前面,男同学排在后面,小亚在排头,小胖在排 2020-05-13 …
二(1)班同学参观科学馆,在门口排成一路纵队.女同学排在前面,男同学排在后面,小亚在排头,小胖在排 2020-05-13 …
用糖拌西红柿,不久会有许多汁液流出,其原因是外界溶液的浓度西红柿细胞的细胞浓度,造成细胞失水,其状 2020-06-23 …
如图,甲、乙、丙是三个车站.乙站到甲、丙两站的距离相等.小明和小强分别从甲、丙两站同时出发相向而行 2020-06-30 …
小红和小芳都积攒了一些零用钱.她们所攒钱的比是5:3,在“支援灾区”捐款活动中小红捐26元,小芳捐 2020-07-01 …
周末,小明骑自行车从家里出发到野外郊游.从家出发0.5小时后到达甲地,游玩一段时间后按原速前往乙地 2020-07-14 …
小李和小王共存款216元.如果小李取出自己存款的25,小王取出24元,现在两人所存的钱数相等.小李 2020-07-19 …
我们知道:分式和分数有着很多的相似点.如类比分数的基本性质,我们得到了分式的基本性质;类比分数的运算 2020-11-07 …
小红和小芳都积攒了一些零用钱.她们所攒钱的比是5:3,在“支援灾区”捐款活动中小红捐26元,小芳捐1 2020-11-18 …
分式和分数有着很多的相似点,如类比分数的基本性质,我们得到了分式的基本性质,等等.小学里,把分子比分 2020-11-29 …