早教吧作业答案频道 -->化学-->
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略
题目详情
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5和HCl,遇o2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
请回答下列问题
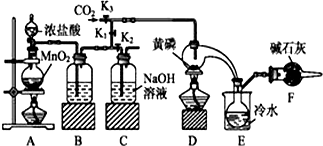
(1)装置中制氯气的离子方程式为___
(2)B中的试剂是___,E中次冷水的作用是___,F中碱石灰的作用是___
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是___通过控制K1、K2能除去A、B装置中的空气,具体的方法是___
(4)粗产品含有POCl3、PCl3等,加入黄磷加热除去PCl5,通过___(填实验操作的名称),即可得到纯净的PCl3
(5)通过下面方法可测定产品中PCl3的质量分数.
①迅速称取100g产品,加水反应后配成250mL溶液;
②取以上溶液25.0mL,向其中加入0.1mol 10mL碘水,充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.1mol/L的Na2S2O3溶液滴定,滴定终点现象是___
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.已知H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2SO4根据以上数据,该产品中PC3的质量分数是___.
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5和HCl,遇o2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| PCl5 | 2 | 105.3 |

(1)装置中制氯气的离子方程式为___
(2)B中的试剂是___,E中次冷水的作用是___,F中碱石灰的作用是___
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是___通过控制K1、K2能除去A、B装置中的空气,具体的方法是___
(4)粗产品含有POCl3、PCl3等,加入黄磷加热除去PCl5,通过___(填实验操作的名称),即可得到纯净的PCl3
(5)通过下面方法可测定产品中PCl3的质量分数.
①迅速称取100g产品,加水反应后配成250mL溶液;
②取以上溶液25.0mL,向其中加入0.1mol 10mL碘水,充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.1mol/L的Na2S2O3溶液滴定,滴定终点现象是___
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.已知H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2SO4根据以上数据,该产品中PC3的质量分数是___.
▼优质解答
答案和解析
实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应.
(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
故答案为:浓硫酸;防止PCl3挥发(冷凝);吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应,先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,排净了空气,再打开K1,关闭K2,
故答案为:排尽装置中的空气,防止黄磷(白磷)自燃;先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏;
(5)②碘遇淀粉显蓝色,用0.1mol/L的Na2S2O3溶液滴定溶液中的碘,当碘反应完毕时,溶液的蓝色会褪色,所以滴定终点的现象为溶液由蓝色变为无色,且半分钟内不变色,
故答案为:溶液由蓝色变为无色,且半分钟内不变色;
③0.1000mol•L-1碘溶液10.00mL中含有碘单质的物质的量为:0.1000mol•L-1×0.0100L=0.00100mol,根据反应I2+2Na2S2O3=2NaI+Na2S4O6可知,与磷酸反应消耗的碘单质的物质的量为:0.00100mol-0.1000mol•L-1×0.00084L×
=0.00058mol,再由H3PO3+H2O+I2=H3PO4+2HI可知,25mL三氯化磷水解后的溶液中含有的H3PO3的物质的量为:n(H3PO3)=n(I2)=0.00058mol,250mL该溶液中含有H3PO3的物质的量为:0.00058mol×
=0.0058mol,所以100g产品中含有的三氯化磷的物质的量为0.0058mol,该产品中PCl3的质量分数为:
×100%=0.8%;
故答案为:0.8%.
(1)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)因PCl3遇水会强烈水解,所以氯气需干燥,氯气和浓硫酸不反应,所以能用浓硫酸干燥氯气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应,
故答案为:浓硫酸;防止PCl3挥发(冷凝);吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(3)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应,先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,排净了空气,再打开K1,关闭K2,
故答案为:排尽装置中的空气,防止黄磷(白磷)自燃;先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2;
(4)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏;
(5)②碘遇淀粉显蓝色,用0.1mol/L的Na2S2O3溶液滴定溶液中的碘,当碘反应完毕时,溶液的蓝色会褪色,所以滴定终点的现象为溶液由蓝色变为无色,且半分钟内不变色,
故答案为:溶液由蓝色变为无色,且半分钟内不变色;
③0.1000mol•L-1碘溶液10.00mL中含有碘单质的物质的量为:0.1000mol•L-1×0.0100L=0.00100mol,根据反应I2+2Na2S2O3=2NaI+Na2S4O6可知,与磷酸反应消耗的碘单质的物质的量为:0.00100mol-0.1000mol•L-1×0.00084L×
| 1 |
| 2 |
| 250mL |
| 25mL |
| 137.5g/mol×0.0058mol |
| 100g |
故答案为:0.8%.
看了 半导体生产中常需要控制掺杂,...的网友还看了以下:
如图为模拟膈肌的运动示意图,据图回答:(1)图中①模拟的结构是,②模拟的结构是.(2)图B表示状态 2020-07-02 …
如图为模拟膈肌的运动示意图,据图回答:(1)图中①模拟的结构是,②模拟的结构是.(2)图B表示状态 2020-07-02 …
如图为模拟膈肌的运动示意图,据图回答:(1)图中①模拟的结构是,②模拟的结构是.(2)图B表示状态 2020-07-02 …
如图是模拟膈肌的运动的演示实验模型,请你根据所做的实验过程完成下列各题.(1)该模型此时模拟的状态是 2020-11-05 …
如图为模拟隔肌的运动示意图,请据图回答问题.(1)图甲中模拟人体的胸廓,模拟人体的肺.(填字母)(2 2020-11-05 …
如图为模拟膈肌的运动示意图,据图回答:(1)图表示吸气状态.(2)图中①模拟人体的,②模拟.(3)图 2020-11-05 …
三线制模拟量接法?S7-315系统现场有一台仪表,三线制4-20MA输出。由于需要2处采集,电源由A 2020-11-29 …
如图装置模拟人体呼吸运动,下列相关叙述正确的是()A.甲图模拟呼气,此时肺内压小于外界B.处于乙图状 2020-12-10 …
如图为模拟膈肌的运动示意图,据图回答(1)图表示吸气状态.图B中①模拟人体的,瓶底的橡皮膜代表的是. 2020-12-24 …
图示模拟膈肌运动的模型,请据图回答:(1)模型中模拟肺的结构是,其中玻璃瓶模拟的结构是.(2)判断甲 2020-12-24 …