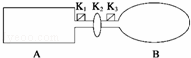
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K 2 ,将等量且少量的NO 2 通过K 1 、K 3 分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO 2 (g) ⇌ N 2 O 4 (g)△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N 2 O 4 的速率是v A v B (填“>”、“<”或“=”);若打开活塞K 2 ,气球B将 (填“变大”、“变小”或“不变”).
(2)关闭活塞K 2 ,若在A、B中再充入与初始量相等的NO 2 ,则达到平衡时,NO 2 的转化率α A 将 (填“增大”、“减小”或“不变”);若分别通人等量的氖气,则达到平衡时,A中NO 2 的转化率将 ,B中NO 2 的转化率将 (填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深.
【考点】 化学平衡的计算;化学平衡的影响因素.
【专题】 平衡思想;演绎推理法;化学平衡计算.
【分析】 (1)容器A为恒温恒容,容器B为恒温恒压,随反应进行A中压强降低,故A中压强小于B中压强,压强越大,反应速率越快;
A中压强小于B中的压强,若打开活塞K 2 ,气球B的压强减小;
(2)容器A为恒温恒容,再通入一定量的NO 2 ,等效为增大压强到达的平衡,增大压强平衡向正反应方向移动;
容器A为恒温恒容,通入氖气,反应混合物各组分浓度不变,平衡不移动;
容器B为恒温恒压,通入氖气使体系的容积增大,反应混合物的浓度降低,相当于为降低压强,平衡向逆反应方向移动;
(3)该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO 2 的浓度增大;
【解答】 (1)容器A为恒温恒容,容器B为恒温恒压,随反应进行A中压强降低,故A中压强小于B中压强,压强越大,反应速率越快,故A、B中生成的N 2 O 4 的速率是V(A)<V(B),A中压强小于B中的压强,若打开活塞K 2 ,气球B的压强减小,则体积变小,
故答案为:<;变小;
(2)容器A为恒温恒容,再通入一定量的NO 2 ,等效为增大压强到达的平衡,增大压强平衡向正反应方向移动,NO 2 的转化率α(A)增大;
容器A为恒温恒容,通入氖气,反应混合物各组分浓度不变,平衡不移动,A中NO 2 的转化率不变;
容器B为恒温恒压,通入氖气使体系的容积增大,反应混合物的浓度降低,相当于为降低压强,平衡向逆反应方向移动,B中A中NO 2 的转化率变小,
故答案为:增大;不变;减小;
(3)该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO 2 的浓度增大,颜色变深,
故答案为:A.
【点评】 本题考查化学平衡计算、化学平衡影响因素,(2)中注意利用等效思想进行分析解答,难度中等.
相距较近的a,b线圈,要使b线圈中产生图示I方向的电流,可采用的办法有()A.闭合K瞬间B.K闭合 2020-04-08 …
已知y=kx与y"=k’x+b交于a (3,4),y"=k’x+b交y轴于b,o为坐标原点△aob 2020-05-17 …
已知等边三角形AOB中,OB在X轴正半轴上,OA=2,将三角形AOB绕点O逆时针旋转60°,点A与 2020-05-22 …
已知关于x,y的二元二次方程x∧2+y∧2+2x-4y+k=0(k∈R)表示圆C.是否存在实数K使 2020-06-14 …
自动控制原理一道计算题求解设单位反馈系统的开环传递函数为G(小k)=K/s(1+0.33s)(1+ 2020-07-18 …
已知圆O和圆K是球O的大圆和小圆,其公共弦长等于球O的半径,OK=32,且圆O与圆K所在的平面所成 2020-07-29 …
如何证明n^3sin(nπ/6)=O(n^4)当n接近无限大是正确的大O符号要求是的|n^3sin 2020-08-01 …
若lnx/(x-1)+1/x大于lnx/(x+1)+k/x对于x大于o且不等于1恒成立,求k取值范围 2020-11-10 …
已知圆O:x2+y2=4,若焦点在x轴上的椭圆过点P(0,-1),且其长轴长等于圆O的直径,过点P作 2020-12-01 …
已知圆O和圆K是球O的大圆和小圆,其公共弦长等于球O的半径,OK=32,且圆O与圆K所在的平面所成的 2021-02-04 …